Estrutura de dissulfeto de carbono (CS2), propriedades, usos, riscos
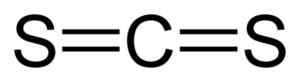
- 1682
- 333
- Terrell Stokes
Ele dissulfeto de carbono É um composto formado pela união de um átomo de carbono (c) e dois átomos de enxofre (s). Sua fórmula química é CS2. É um líquido incolor ou ligeiramente amarelo com um cheiro desagradável devido às impurezas que ele contém (compostos de enxofre). Quando puro, seu cheiro é macio e doce, semelhante ao clorofórmio ou éter.
Naturalmente se origina da ação da luz solar em moléculas orgânicas encontradas na água do mar. Além disso, ocorre em águas do pântano e também é expulso de vulcões junto com outros gases.
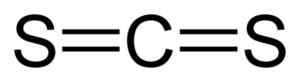 CS dissulfeto de carbono2. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
CS dissulfeto de carbono2. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. O dissulfeto de carbono é um fluido volátil e também é muito inflamável, por isso deve ser mantido longe de chamas, faíscas ou dispositivos que podem produzi -los, incluindo lâmpadas elétricas.
Ele tem a capacidade de dissolver um grande número de compostos, materiais e elementos, como fósforo, enxofre, selênio, resinas, lacas, etc. Portanto, encontra a utilidade como um solvente.
Também é intermediário em várias reações químicas industriais, como produção de rayon ou seda artificial.
Deve ser manipulado com cautela e com implementos de proteção porque é muito tóxico e perigoso.
[TOC]
Estrutura
Dissulfeto de carbono tem um átomo de carbono e dois átomos de enxofre nas laterais deste.
Os vínculos entre o átomo de carbono e os átomos de enxofre são covalentes e duplos, portanto são muito fortes. A molécula CS2 Tem uma estrutura linear e simétrica.
 Estrutura linear de dissulfeto de carbono CS2. Preto = carbono, amarelo = enxofre. Autor: Benjah-BMM27. Fonte: Wikimedia Commons.
Estrutura linear de dissulfeto de carbono CS2. Preto = carbono, amarelo = enxofre. Autor: Benjah-BMM27. Fonte: Wikimedia Commons. Nomenclatura
- Dissulfeto de carbono
- Bisulfeto de carbono
- Anidrido ditiocarbônico
Propriedades
Estado físico
Incolor a amarelado.
Peso molecular
76,15 g/mol
Ponto de fusão ou solidificação
-110,8 ° C
Ponto de ebulição
46.0 ºC
Ponto de inflamação
-30 ºC (método de copo fechado).
Temperatura de auto -dirigir
90 ° C
Densidade
Líquido = 1,26 g/cm3 A 20 ºC.
Vapor = 2,67 vezes o ar.
Seus vapores são mais que o dobro pesado que o ar e o líquido é mais pesado que a água.
Pressão de vapor
279 mmHg a 25 ° C.
Pode servir você: Hipoclorito de potássio (KCLO)Esta é uma alta pressão de vapor.
Solubilidade
Muito pouco solúvel em água: 2,16 g/L a 25 ° C. Solúvel em clorofórmio. Miscível com etanol, metanol, éter, benzeno, clorofórmio e tetracloreto de carbono.
Propriedades quimicas
O cs2 Ele evapora facilmente à temperatura ambiente porque seu ponto de ebulição é muito baixo e sua pressão de vapor é muito alta.
Dissulfeto de carbono é extremamente inflamável. Seus vapores estão facilmente inflamados, mesmo com o calor de uma lâmpada elétrica. Isso significa que ele reage com oxigênio muito rapidamente:
Cs2 + 3 o2 → co2 + 2 Então2
O fato de você ter alta pressão de vapor à temperatura ambiente torna perigoso estar perto de uma chama.
Quando aquecido para decomposição pode explorar facilmente, emitir gases tóxicos de óxidos de enxofre. Acima de 90 ° C é ativado espontaneamente.
Ele quebra quando armazenado por um longo tempo. Atacar cobre e suas ligas. Também reage com alguns plásticos, borrachas e revestimentos.
Reage sob certas condições com água, formando o sulfeto de carbonil OCS, dióxido de carvão Co2 e dissulfeto de hidrogênio H2S:
Cs2 + H2O → OCS + H2S
Cs2 + 2 h2O → co2 + 2 h2S
Com álcoois (ROH) no meio alcalino, formam xantatos (RO-CS-NNA):
Cs2 + Roh + Naoh → h2Ou + ro -c (= s) -sna
Obtenção
O dissulfeto de carbono é preparado comercialmente por reação de enxofre com carvão. O processo é realizado a temperaturas de 750-900 ° C.
C + 2 S → CS2
Em vez de carvão, você também pode usar metano ou gás natural, e até etano, propano e propileno foram usados; nesse caso, a reação ocorre a 400-700 ° C com alto desempenho.
Também pode ser preparado reagindo gás natural com sulfeto de hidrogênio H2É uma temperatura muito alta.
Presença na natureza
O cs2 É um produto natural presente na atmosfera em quantidades muito pequenas (traços). Ocorre fotoquimicamente em águas superficiais.
A ação da luz solar em certos compostos presentes na água do mar, como a cisteína (um aminoácido), leva à formação de dissulfeto de carbono.
 O dissulfeto de carbono pode ser formado pela ação dos raios solares em alguns compostos orgânicos presentes na água do mar. Autor: Pexels. Fonte: Pixabay.
O dissulfeto de carbono pode ser formado pela ação dos raios solares em alguns compostos orgânicos presentes na água do mar. Autor: Pexels. Fonte: Pixabay. Também é lançado naturalmente durante erupções vulcânicas e é encontrado em pequenas quantidades sobre os pântanos.
Pode servir você: benzaldeídoNormalmente, estamos expostos a respirar proporções muito pequenas e está presente em alguns alimentos. Também é encontrado na fumaça dos cigarros.
No ambiente, ele se decompõe através da luz solar. No chão, ele se move através dele. Alguns microorganismos do solo quebram.
Formulários
Na indústria química
O dissulfeto de carbono é um composto químico importante, pois serve para preparar outros produtos químicos. Pode atuar como um intermediário químico.
Também é usado como solvente de processo, por exemplo, para dissolver fósforo, enxofre, selênio, bromo, iodo, gorduras, resinas, ceras, lacas e borralhas.
Permite a fabricação de produtos farmacêuticos e herbicidas, entre outros.
Na produção de Rayón e Celofán
Com cs2 Xantatos são preparados que são compostos usados na fabricação de Rayón e Celofán.
Para obter seda ou rayon artificial, é baseado em celulose, que é tratada com alcalina e dissulfeto de carbono CS2 e se transforma em xantato de celulose, solúvel em álcalis. Esta solução é viscosa e, portanto, é chamada de "viscosa".
A viscose é feita sob pressão através de orifícios muito pequenos dentro de um banho ácido. Aqui, o xantato de celulose é transformado novamente em celulose, que é insolúvel e fios longos e brilhantes são formados.
Tópicos ou filamentos podem ser girados para dar um material conhecido como Rayón.
(1) celulose + NaOH → Alcali-celulosa
Roh + Naoh → Rona
(2) alcali-celulose + dissulfeto de carbono → xantato de celulose
RONA + S = C = S → RO -C (= S) -SNA
(3) xantato de celulose + ácido → celulose (filamentos)
Ro -c (= s) -sna + ácido → roh
 Roupas feitas com rayon, fibra cuja fabricação participa do dissulfeto de carbono. Tobias "Take" Maier [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons.
Roupas feitas com rayon, fibra cuja fabricação participa do dissulfeto de carbono. Tobias "Take" Maier [CC BY-SA (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Fonte: Wikimedia Commons. Se a celulose for precipitada passando o Xantato por um slot estreito, a celulose será regenerada na forma de folhas finas que compõem o celofane. Isso é suavizado com glicerol e é usado como um filme de proteção de objeto.
 O celofane é fabricado com a ajuda de dissulfeto de carbono. Autor: Hans Braxmeier. Fonte: Pixabay.
O celofane é fabricado com a ajuda de dissulfeto de carbono. Autor: Hans Braxmeier. Fonte: Pixabay. Na produção de tetracloreto de carbono
O dissulfeto de carbono reage com o cloro CL2 Para dar ao tetracloreto de carbono CCL4, que é um solvente importante que não é combustível.
Pode atendê -lo: clorobenzeno (C6H5Cl)Cs2 + 3 Cl2 → CCL4 + S2Cl2
Em várias aplicações
O dissulfeto de carbono participa da vulcanização a frio da borracha.
Os Xantatos preparados com CS2 Eles são usados na flotação mineral.
Usos antigos
O cs2 É um veneno para organismos vivos. Anteriormente, era usado para destruir pragas como ratos, marmotas e formigas, derramando o líquido em todos os espaço fechados em que esses animais viviam (tocas e hormiGueros))).
Quando os densos vapores tóxicos foram usados para esse fim, eles terminaram todos os organismos vivos que estavam no espaço confinado.
Também foi usado como anti -helmíntico para animais e para eliminar larvas de Moscardons do estômago dos cavalos.
Na agricultura, foi usado como inseticida e nematicida, para fumigar o solo, a fumigação de viveiros, celeiros, silos e moinhos de cereais. Carros, navios e barcaças também foram fumigados.
 Fazendeiro em 1904 Fumigando o solo com dissulfeto de carbono para combater uma praga de plantas de uva. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/licenças/licendas antigas/fdl-1.2.html)]. Fonte: Wikimedia Commons.
Fazendeiro em 1904 Fumigando o solo com dissulfeto de carbono para combater uma praga de plantas de uva. Ölgemälde von Hans Pühringer, 1904 [GFDL 1.2 (http: // www.gnu.Org/licenças/licendas antigas/fdl-1.2.html)]. Fonte: Wikimedia Commons. Todos esses usos foram proibidos devido à alta inflamabilidade e toxicidade do CS2.
Riscos
O cs2 É altamente inflamável. Muitas de suas reações podem causar incêndio ou explosão. As misturas de seus vapores com ar são explosivas. Quando a inflamação produz gases irritantes ou tóxicos.
O dissulfeto de carbono para os drenos não deve ser derramado, porque nos tubos há uma mistura de cs2 e o ar que pode causar uma explosão se for iluminado por acidente.
Seus vapores disparam espontaneamente em contato com faíscas ou superfícies quentes.
O dissulfeto de carbono irrita severamente os olhos, a pele e as membranas mucosas.
Se o sistema nervoso central é inalado ou ingerido seriamente, o sistema cardiovascular, olhos, rins e fígado. Também pode ser absorvido pela pele causando danos.
Referências
- OU.S. Biblioteca Nacional de Medicina. (2020). Carbono dissulfeto. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Mopper, k. E Kieber, D.J. (2002). Fotoquímica e ciclismo de carbono, enxofre, nitrogênio e pospherus. Na biogeoquímica da matéria orgânica dissolvida marinha. Recuperado de cientedirect.com.
- Meyer, b. (1977). Usos industriais de enxofre e seus compostos. Carbono dissulfeto. Em enxofre, energia e inveja. Recuperado de cientedirect.com.
- Pohanish, r.P. (2012). C. Carbono dissulfeto. No Manual de Químicos Tóxicos e Químicos Tóxicos e Perigosos (Sexta Edição). Recuperado de cientedirect.com.
- Morrison, r.T. e boyd, r.N. (2002). Química orgânica. 6ª edição. Prentice-Hall.
- Windholz, m. et al. (Editores) (1983). O índice Merck. Uma eniclopédia de produtos químicos, medicamentos e biológicos. Décima edição. Merck & co., Inc.
- « As 95 melhores frases dos santos católicos
- +105 frases católicas sobre fé, reflexão, oração e esperança »

