Curva de aquecimento O que é, como é fazer, exemplos

- 4471
- 477
- Terrence King IV
A Curva de aquecimento É a representação gráfica de como a temperatura de uma amostra varia em função do tempo, mantendo a pressão constante e adicionando calor uniformemente, isto é, a uma taxa constante.
Para construir esse gráfico, são tomados pares de valores de temperatura e tempo, que subsequentemente representam a temperatura no eixo vertical (ordenado) e o tempo no eixo horizontal (Abcissa).
 figura 1. A curva de aquecimento de uma substância é obtida adicionando calor e medindo a temperatura a cada determinado intervalo de tempo. Fonte: Pixabay.
figura 1. A curva de aquecimento de uma substância é obtida adicionando calor e medindo a temperatura a cada determinado intervalo de tempo. Fonte: Pixabay. Em seguida, a curva mais apropriada para esses pontos experimentais é ajustada e, finalmente, um gráfico da temperatura t é obtido em função do tempo t: t (t).
[TOC]
Qual é a curva de aquecimento?
À medida que aquece, uma substância está passando por estados sucessivamente diversos: ser sólido pode vapor, quase sempre passando pelo estado líquido. Esses processos são chamados de mudanças de estado, nas quais a amostra aumenta sua energia interna ao adicionar calor, conforme indicado pela teoria cinética molecular.
Ao adicionar calor a uma amostra, existem duas possibilidades:
- A substância aumenta sua temperatura, tendo em vista o fato de que suas partículas são agitadas com maior intensidade.
- O material está passando por uma mudança de fase, na qual a temperatura permanece constante. Adicionar calor tem o efeito de enfraquecer até certo ponto as forças que mantêm as partículas coesas, por isso é fácil passar do gelo para a água líquida, por exemplo.
A Figura 2 mostra os quatro estados da matéria: sólido, líquido, gás e plasma, e os nomes dos processos que permitem a transição entre si. As setas indicam o significado do processo.
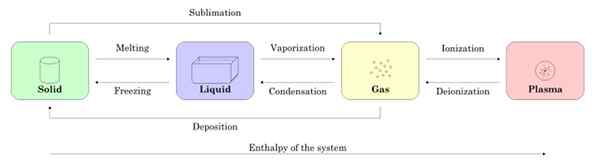 Figura 2. Os estados do sujeito e processos necessários para passar entre um e o outro. Fonte: Wikimedia Commons.
Figura 2. Os estados do sujeito e processos necessários para passar entre um e o outro. Fonte: Wikimedia Commons. -Mudanças estaduais em uma substância
Começando com uma amostra em estado sólido, quando a fusão passa para o estado líquido, pois é vaporizado, torna -se gás e, através da ionização, torna -se plasma.
Pode atendê -lo: propriedades magnéticas dos materiaisO sólido pode se tornar diretamente gás através do processo conhecido como sublimação. Existem substâncias que facilmente sublim à temperatura ambiente. O mais conhecido é co2 ou gelo seco, bem como naftaleno e iodo.
Enquanto a amostra atravessa uma mudança de estado, a temperatura permanece constante até atingir o novo estado. Isso significa que, se, por exemplo, houver uma porção de água líquida que atingiu seu ponto de ebulição, sua temperatura permanece constante até que toda a água se torne vapor.
Por esse motivo, espera -se que a curva de aquecimento seja composta por uma combinação de seções em crescimento e seções horizontais, onde este corresponde às mudanças de fase. A Figura 3 mostra uma dessas curvas para uma determinada substância.
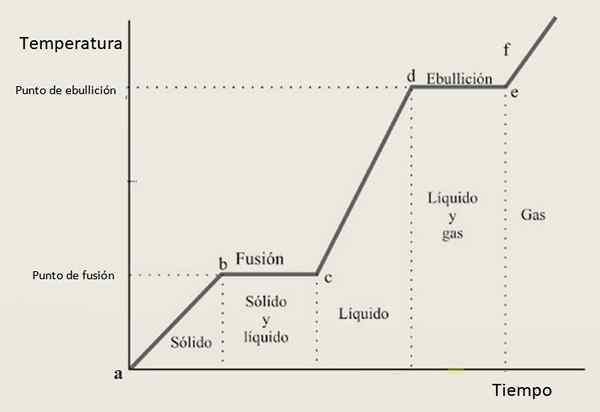 Figura 3. Uma curva de aquecimento de uma determinada substância, com a configuração típica com base em etapas e inclinações.
Figura 3. Uma curva de aquecimento de uma determinada substância, com a configuração típica com base em etapas e inclinações. Interpretação da curva de aquecimento
Em intervalos de crescimento Ab, CD e Ef A substância é encontrada como sólida, líquida e gás, respectivamente. Nessas regiões, a energia cinética aumenta e com ela a temperatura.
Enquanto isso em Bc Seu estado de sólido para líquido está mudando, portanto as duas fases coexistem. Este é o caso na seção de, em que a amostra passa do fluido de gás. Aqui está mudando a energia potencial, e a temperatura permanece constante.
O procedimento inverso também é possível, ou seja, a amostra pode ser resfriada para que adote sucessivamente outros estados. Nesse caso, se fala de curva de resfriamento.
As curvas de aquecimento têm o mesmo aspecto geral para todas as substâncias, embora não seja os mesmos valores numéricos. Algumas substâncias exigem mais tempo do que outras para mudar de estado, derreter e vaporizar a diferentes temperaturas.
Esses pontos são conhecidos respectivamente como ponto de fusão e ponto de ebulição, e são características de cada substância.
Pode atendê -lo: espelhos planos: equação, comportamento, gráficosÉ por isso que as curvas de aquecimento são muito úteis, pois indicam o valor numérico dessas temperaturas para milhões de substâncias que existem como sólidos e líquidos na faixa de temperaturas consideradas normais e à pressão atmosférica.
Como é feita uma curva de aquecimento?
Em princípio, é muito simples: basta colocar uma amostra de substância em um recipiente fornecido com um agitador, introduzir um termômetro e calor uniformemente.
Simultaneamente, no início do procedimento, um cronômetro é ativado e os casais de tempo de temperatura correspondentes são observados.
A fonte de calor pode ser um isqueiro a gás, com boa velocidade de aquecimento ou uma resistência elétrica que, quando o calor emite calor, que pode se conectar a uma fonte variável para obter diferentes poderes.
Para mais precisão, existem duas técnicas amplamente utilizadas no Laboratório de Química:
- Análise térmica diferencial.
- Calorimetria de varredura diferencial.
Eles comparam a diferença de temperatura entre a amostra em estudo e outra amostra de referência com alta temperatura de fusão, quase sempre um óxido de alumínio. Esses métodos buscam encontrar facilmente pontos de fusão e ebulição.
Exemplos (água, ferro ...)
Considere as curvas de aquecimento para água e ferro mostrado na figura. A escala de tempo não é mostrada, no entanto, é imediato.
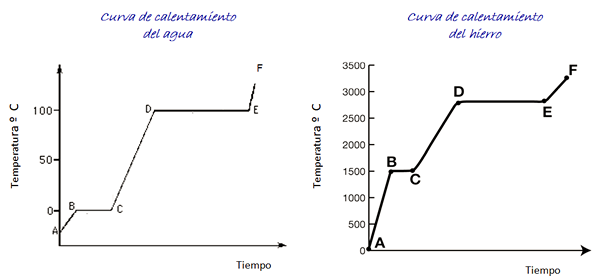 Figura 4. Curvas de aquecimento de água e ferro.
Figura 4. Curvas de aquecimento de água e ferro. A água é uma substância universal e a faixa de temperatura necessária para ver suas mudanças de estado é fácil de alcançar no laboratório. Para o ferro, são necessárias temperaturas muito mais altas, mas, como indicado acima, a forma do gráfico não muda substancialmente.
Pode servir a você: Teorema de Steiner: Explicação, Aplicações, ExercíciosDerreter gelo
Ao aquecer a amostra de gelo, de acordo com o gráfico, estamos no ponto A, a uma temperatura abaixo de 0º C. Observa -se que a temperatura aumenta a uma taxa constante até atingir 0º C.
Moléculas de água dentro do gelo vibram mais largura. Uma vez atingido a temperatura de fusão (ponto B), as moléculas já podem se mover na frente de outro.
A energia que chega é investida na redução da força de atração entre as moléculas, de modo que a temperatura entre B e C permanece constante a todo o gelo derretido.
Transformando água em vapor
Uma vez que a água está totalmente em estado líquido, a vibração das moléculas aumenta novamente e a temperatura aumenta rapidamente entre C e D até o ponto de ebulição em 100º C. Entre d e e a temperatura permanece nesse valor enquanto a energia que chega é responsável por toda a água no recipiente para evaporar.
Se todo o vapor de água estiver contido em um recipiente, ele poderá ser continuado do ponto E ao ponto F, cujo limite não é mostrado nos gráficos.
Uma amostra de ferro pode atravessar essas mesmas mudanças. No entanto, dada a natureza do material, as faixas de temperatura são muito diferentes.
Referências
- Atkins, p. Princípios da química: os caminhos da descoberta. Editorial médico pan -American. 219-221.
- Chung, p. Curvas de aquecimento. Recuperado de: química.Librettexts.org.
- Curvas de aquecimento. Calor de fusão e vaporização. Recuperado de: WikiPremed.com.
- Hewitt, Paul. 2012. Ciência física conceitual. 5 ª. Ed. Pearson. 174-180.
- Universidade de Valladolid. Formado em química, recuperado de: acomodação.uva.é.
- « Estágios de ciclo de carnot, aplicações, exemplos, exercícios
- Características verdes de bromocresol, preparação, usa »

