Quais são as leis de peso da química? (Exemplos)

- 2262
- 308
- Alfred Kub
As Leis de Weareral da química São aqueles que mostraram que as massas das substâncias que reagirem não o fazem arbitrariamente ou aleatoriamente; Mas manter uma proporção matemática constante de números inteiros ou submultiplos deles, nos quais os átomos dos elementos não são criados ou destruídos.
Nos últimos tempos, estabelecendo essas leis exigia esforços extraordinários de raciocínio; Porque, embora agora pareça muito evidente, antes que as massas atômicas ou moleculares dos elementos ou compostos nem sequer fossem conhecidas, respectivamente.
 Fonte: Jeff Keyzer de Austin, TX, EUA [CC BY-SA 2.0 (https: // CreativeCommons.Org/licenças/BY-SA/2.0)]
Fonte: Jeff Keyzer de Austin, TX, EUA [CC BY-SA 2.0 (https: // CreativeCommons.Org/licenças/BY-SA/2.0)] Como não se sabia como exatamente um mol de átomos de cada elemento eram equivalentes, os produtos químicos dos séculos XVIII e XIX tiveram que se basear nas massas reagentes. Para que escalas analíticas rudimentares (imagem superior) fossem companheiros inseparáveis durante as centenas de experimentos necessários para a liquidação das leis de ponderação.
É por esse motivo que, quando essas leis da química são estudadas, elas tropeçaram em medições de massa a cada momento. Graças a isso, extrapolando os resultados dos experimentos, foi descoberto que os compostos químicos Puro Eles sempre se formam com a mesma proporção de massa de seus elementos constituintes.
[TOC]
Lei da conservação de massa
Esta lei diz que, em uma reação química, a massa total dos reagentes é igual à massa total dos produtos; Enquanto o sistema considerado estiver fechado e não há troca de massa e energia com o ambiente.
Em uma reação química, as substâncias não desaparecem, mas são transformadas em outras substâncias de massa igual; A partir daí, a famosa frase: "Nada é criado, nada é destruído, tudo é transformado".
Historicamente, a lei da conservação em massa em uma reação química foi proposta pela primeira vez em 1756 por Mikhail Lomonsov, que mostrou em seu diário os resultados de seus experimentos.
Posteriormente, em 1774, Antoine Levoisier, um químico francês, apresentou os resultados de seus experimentos que permitiram estabelecer isso; que, alguns também chamam de lei de Lavoisier.
-Experimentos de Lavoisier
Na época de Lavoisier (1743-1794), havia a teoria de Flogisto, segundo a qual os corpos tinham a capacidade de inflamar ou queimar. Experimentos de Lavoisier permitiram descartar essa teoria.
Lavoisier realizou inúmeras experiências de combustão de metal. Ele pesou cuidadosamente os materiais antes e depois de sua combustão em um recipiente fechado, descobrindo que havia um aparente ganho de peso.
Mas Lavoiser, com base no conhecimento do papel do oxigênio na combustão, concluiu que o ganho de peso na combustão foi devido à incorporação de oxigênio no material de combustão. O conceito de óxidos metálicos nasceu.
Portanto, a soma das massas dos metais submetidos a combustão e oxigênio permaneceu inalterável. Esta conclusão permitiu o estabelecimento da lei de conservação em massa.
-Equilíbrio de equações
A lei de conservação em massa estabeleceu a necessidade de equilibrar equações químicas, garantindo que o número de todos os elementos envolvidos em uma reação química, bem como reagentes ou produtos, é exatamente o mesmo.
Este é um requisito essencial para a precisão dos cálculos estequiométricos que são feitos.
-Cálculos
Toupeiras de água
Quantas moles de água podem ocorrer durante a combustão de 5 moles de metano em um excesso de oxigênio? Também demonstra que a lei da conservação da matéria é cumprida.
CH4 + 2 o2 => Co2 + 2 h2QUALQUER
Observando a equação equilibrada da reação, conclui -se que 1 mol de metano produz 2 moles de água.
O problema pode ser resolvido diretamente com uma abordagem simples, pois não temos 1 mol, mas 5 moles de CHO4:
Moles de água = 5 moles de Cho4· (2 moles de H2O / 1 mol de Cho4)
= 10
O que seria equivalente a 180 g de H2QUALQUER. 5 mol ou 220 g de CO também foram formados2, que é igual a uma massa total de 400 g de produtos.
Assim, para a lei da conservação do sujeito reagir 400 g de reagentes; nem mais nem menos. Desses 400 g, 80 g correspondem aos 5 moles de Cho4 (multiplicando por sua massa molecular de 16 g/mol) e 320 g a 10 moles de O2 (Da mesma forma, devido à sua massa molecular de 32 g/mol).
Combustão de uma fita de magnésio
Uma fita de magnésio de 1,50 g queimou em um recipiente fechado contendo 0,80 g de oxigênio. Após a combustão, 0,25 g de oxigênio estava no recipiente. a) Que massa de oxigênio reagiu? b) quanto óxido de magnésio foi formado?
Pode servir a você: solução hipotônica: componentes, preparação, exemplosA massa de oxigênio que reagiu é obtida por uma diferença simples.
Massa de oxigênio consumida = (massa inicial - massa residual) oxigênio
= 0,80 g - 0,25 g
= 0,55 g ou2 (para)
De acordo com a lei de conservação em massa,
Massa de óxido de magnésio = massa de magnésio +massa de oxigênio
= 1,50 g + 0,55 g
= 2,05 g de MGO (b)
Lei de proporções definidas
Joseph Louis Proust (1754-1826), químico francês, percebeu que em uma reação química os elementos químicos sempre reagem em proporções de massa fixa para formar um composto puro em específico; Portanto, sua composição é constante, independentemente da fonte ou origem, ou como ela é sintetizada.
Proust, em 1799, afirmou que a lei das proporções definidas, que afirma que: "Quando dois ou mais elementos são combinados para formar um composto, eles o fazem em um relacionamento de massa fixa". Portanto, esse relacionamento é fixo e não depende da estratégia seguida para a preparação do composto.
Esta lei também é conhecida como a lei da composição constante, que afirma que: "Todo composto químico em pureza sempre contém os mesmos elementos, em uma proporção constante de massa".
-Ilustração da lei
O ferro (fé) reage com o enxofre para formar sulfeto de ferro (FES), três situações podem ser indicadas (1, 2 e 3):
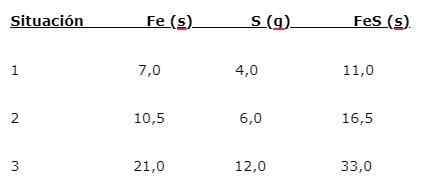
Para encontrar a proporção em que os elementos são combinados, a massa principal (fé) é dividida pela (s) massa (s) menor (s). O cálculo fornece uma proporção de 1,75: 1. Este valor é repetido nas três condições dadas (1, 2 e 3), onde a mesma proporção é obtida, embora diferentes massas sejam usadas.
Ou seja, que 1,75 g de fé são combinados com 1,0 g de s para dar 2,75 g de fes.
-Formulários
Através da aplicação desta lei, você pode saber exatamente as massas dos elementos que devem ser combinados para obter uma massa desejada de um composto.
Dessa maneira, podem ser obtidas informações sobre a massa restante de qualquer um dos elementos envolvidos em uma reação química, ou se houver um reagente limitante na reação.
Além disso, aplica -se a conhecer a composição centesimal de um composto e, com base neste último, a fórmula de um composto pode ser estabelecida.
Composição centesimal de um composto
Dióxido de carbono (CO2) é formado na seguinte reação:
C +o2 => Co2
12 g de carbono 32 g de oxigênio são combinados para fornecer 44 g de dióxido de carbono.
Então, a porcentagem de carbono é igual a
Porcentagem de carbono = (12 g / 44 g) · 100 %
= 27,3 %
Porcentagem de oxigênio = (32 g / 44 g) · 100 %
Porcentagem de oxigênio = 72,7 %
Usando a declaração da lei da composição constante, pode -se notar que o dióxido de carbono é sempre formado por 27,3 % de carbono e 72,7 % de oxigênio.
-Cálculos
Trióxido de enxofre
Ao reagir em diferentes recipientes 4 g e 6 g de enxofre (s) com oxigênio (O), eles foram obtidos, respectivamente, 10 g e 15 g de trióxido de enxofre (então3).
Por que essas quantidades de trióxido de enxofre eram outras e não outras?
Calcule também a quantidade de enxofre necessária para combinar com 36 g de oxigênio e a massa de trióxido de enxofre obtida.
Parte A)
No primeiro recipiente, 4 g de oxigênio são misturados para obter 10 g de trióxido. Se a lei de conservação em massa for aplicada, podemos limpar a massa de oxigênio que foi combinada com enxofre.
Massa de oxigênio = 10 g de trióxido de oxigênio - 4 g de enxofre.
= 6 g
No recipiente 2 6 g de enxofre são misturados com x g de oxigênio para obter 15 trióxido de enxofre.
Massa de oxigênio = 15 g de trióxido de enxofre - 6 g de enxofre
= 9 g
As proporções o/s para cada contêiner são calculadas:
Proporção o / s na situação 1 = 6 g o / 4 g s
= 1,5 / 1
Proporção o / s na situação 2 = 9 g o / 6 g s
= 1,5 / 1
Que, concorda com o que é levantado na lei das proporções definidas, indicando que os elementos são sempre combinados na mesma proporção para formar um certo composto.
Portanto, os valores obtidos estão corretos e aqueles que correspondem à aplicação da lei.
Parte B)
Na seção anterior, um valor de 1,5 / 1 foi calculado para a proporção o / s.
Pode atendê -lo: Estados de agregação da matériag de enxofre = 36 oxigênio · (1 g de enxofre / 1,5 g de oxigênio)
= 24 g
g de trióxido de enxofre = 36 g de oxigênio + 24 g de enxofre
= 60 g
Cloro e magnésio
Cloro e magnésio são combinados na proporção de 2,95 g de cloro para cada g de magnésio. a) Determine as massas de cloro e magnésio necessários para obter 25 g de cloreto de magnésio. b) Qual é a composição percentual de cloreto de magnésio?
Parte A)
Com base no valor de 2,95 para a proporção CL: mg, a seguinte abordagem pode ser feita:
2,95 g de cl +1 g de mg => 3,95 g de mgcl2
Então:
g de cl = 25 g de mgcl2 · (2,95 g cl / 3,95 g mgcl2)
= 18,67
G de mg = 25 g de mgcl2 · (1 g mg / 3,95 g mgcl2)
= 6.33
Então, 18,67 g de cloro são combinados com 6,33 g de magnésio para produzir 25 g de cloreto de magnésio.
Parte B)
A massa molecular de cloreto de magnésio, MGCL é calculada primeiro2:
Peso molecular MGCL2 = 24,3 g/mol + (2,35,5 g/mol)
= 95,3 g/mol
Porcentagem de magnésio = (24,3 g / 95,3 g) x 100 %
= 25,5 %
Porcentagem de cloro = (71 g / 95,3 g) x 100 %
= 74,5 %
Lei de múltiplas proporções ou lei de Dalton
A lei foi declarada em 1803 pelo químico e meteorologista francês John Dalton, com base em suas observações sobre as reações de gases atmosféricos.
A lei foi afirmada da seguinte forma: "Quando os elementos são combinados para dar mais de um composto, uma massa variável de um deles se une a uma massa fixa do outro e a primeira como um relacionamento de cânones e números indistintos".
Além disso: "Quando dois elementos são combinados para causar diferentes compostos, dada uma quantidade fixa de um deles, as diferentes quantidades do outro elemento que são combinadas com essa quantidade fixa para produzir os compostos são em relação a números inteiros simples".
John Dalton fez a primeira descrição moderna do átomo como um componente dos elementos químicos, quando apontou que os elementos são formados por partículas indivisíveis chamadas átomos.
Além disso, ele postulou que os compostos são formados quando átomos de diferentes elementos se combinam entre si em proporções de números inteiros simples.
Dalton completou as obras de pesquisa de Proust. Ele apontou a existência de dois óxidos de lata, com porcentagens de 88,1% e 78,7% de estanho com as porcentagens correspondentes de oxigênio, 11,9% e 21,3%, respectivamente.
-Cálculos
Água e peróxido de hidrogênio
Mostre que os compostos de água, H2Ou, e peróxido de hidrogênio, h2QUALQUER2, Eles cumprem a lei de múltiplas proporções.
Pesos atômicos dos elementos: H = 1 g/mol e oxigênio = 16 g/mol.
Pesos moleculares dos compostos: H2O = 18 g/mol e h2QUALQUER2 = 34 g/mol.
Hidrogênio é o elemento com uma quantidade fixa em H2Ou e h2QUALQUER2, Portanto, as proporções entre O e H serão estabelecidas em ambos os compostos.
O/H proporcionar em H2O = (16 g/mol)/(2 g/mol)
= 8/1
O/H proporcionar em H2QUALQUER2 = (32 g/mol)/(2 g/mol)
= 16/1
Relação entre ambos as proporções = (16/1)/(8/1)
= 2
Em seguida, a proporção entre o ou/h entre peróxido de hidrogênio e água é 2, um número inteiro e um número simples. Há conformidade com a lei de múltiplas proporções.
Óxidos de nitrogênio
Qual massa de oxigênio é combinada com 3,0 g de nitrogênio em a) óxido nítrico, não e b) dióxido de nitrogênio, não2. Mostre que não e não2 Eles cumprem a lei de múltiplas proporções.
Massa de nitrogênio = 3 g
Pesos atômicos: nitrogênio, 14 g/mol e oxigênio, 16 g/mol.
Cálculos
No não, um átomo de n é combinado com 1 átomo de O, de modo que a massa de oxigênio combinada com 3 g de nitrogênio possa ser calculada pela seguinte abordagem:
G de o = g nitrogênio · (PA. O / PA. N)
= 3 g · (16 g/mol/14 g/mol)
= 3,43 g ou
No não2, Um átomo de n é combinado com 2 átomos de O, portanto a massa de oxigênio combinada é:
g de oxigênio = 3 g · (32 g/mol/14 g/mol)
= 6,86 g ou
Proporção o/ n a NO = 3,43 g o/ 3 g n
= 1.143
Proporção ou/n em não2 = 6,86 g o / 3 g n
= 2.282
Valor da relação entre proporções o / n = 2.282 / 1.143
= 2
Então, o valor da relação entre as proporções ou/n é 2, um número inteiro e simples. Portanto, a lei das proporções múltiplas é cumprida.
Lei de proporções recíprocas
Esta lei formulada por Richter e Carl F. Wenzel separado.
Pode atendê -lo: sódio: história, estrutura, propriedades, riscos e usosPor exemplo, se você tiver os dois compostos AB e CB, observa -se que o elemento comum é B.
A lei ou proporções recíprocas de Richter-Wenzel diz que, sabendo quanto de A reage com B para dar AB e quanto C reage com B para dar CB, você pode calcular a massa da qual é necessário para reagir com uma massa C a forma ac.
E o resultado é que a proporção de: c ou a/c deve ser um múltiplo ou submultimo de A/B ou C/B. No entanto, esta lei nem sempre é cumprida, especialmente quando os elementos apresentam vários estados de oxidação.
De todas as leis de peso, isso é talvez o mais "abstrato" ou complicado. Mas se analisado do ponto de vista matemático, será visto que consiste apenas de fatores de conversão e cancelamento.
-Exemplos
Metano
Se souber que 12 g de carbono reagem com 32 g de oxigênio para formar dióxido de carbono; e que, por outro lado, 2 g de hidrogênio reage com 16 g de oxigênio para formar água, as proporções de massa c/o e h/ou para o CO podem ser estimadas2 e h2Ou, respectivamente.
Calcular c/o e h/ou você tem:
C / o = 12g c / 32g ou
= 3/8
H / o = 2g h / 16g ou
= 1/8
O oxigênio é o elemento comum e é desejado saber quanto carbono reage com hidrogênio para produzir metano; Isto é, você deseja calcular C/H (ou H/C). Então, é necessário fazer uma divisão das proporções anteriores para demonstrar se a reciprocidade é ou não cumprida:
C/h = (c/o)/(h/o)
Observe que, dessa maneira, o sistema operacional é cancelado e C/H permanece:
C/h = (3/8)/(1/8)
= 3
E 3 é um múltiplo 3/8 (3/8 x 8). Isso significa que 3 g de C reage com 1 g de h para dar metano. Mas, para poder compará -lo com o CO2, É multiplicado C/H por 4, que é igual a 12; Isso fornece 12 g de C que reagem com 4 g de H para formar metano, o que também é verdadeiro.
Sulfeto de magnésio
Se souber que 24 g de magnésio reagem com 2 g de hidrogênio para formar hidreto de magnésio; Além disso, 32 g de enxofre reagem com 2 g de hidrogênio para formar sulfeto de hidrogênio, o elemento em comum é hidrogênio e deseja calcular mg/s a partir de mg/h e h/s.
Em seguida, calculando mg/h e h/s separadamente você tem:
Mg / h = 24g mg / 2g h
= 12
H / s = 2g h / 32g s
= 1/16
No entanto, é conveniente usar S/H para cancelar H. Portanto, s/h é igual a 16. Fiz isso, continuamos a calcular MG/S:
Mg/s = (mg/h)/(s/h)
= (12/16)
= 3/4
E 3/4 é um envio de 12 (3/4 x 16). A proporção de mg/s indica que 3 g de mg reagem com 4 g de enxofre para formar sulfeto de magnésio. No entanto, você precisa multiplicar mg/s por 8 para poder compará -lo com mg/h. Assim, 24 g de mg reagem com 32 g de enxofre para dar a este sulfeto metálico.
Cloreto de alumínio
Sabe -se que 35,5 g de CL reagem com 1 g de h para formar HCl. Além disso, 27 g de Al reage com 3 g de H para formar Alh3. Calcule a proporção de cloreto de alumínio e diga se esse composto obedece à lei de Richter-Wenzel.
Novamente, Cl/H e AT/H são calculados separadamente:
Cl / H = 35,5g Cl / 1g h
= 35,5
Em/ h = 27g em/ 3g h
= 9
Agora, ele é calculado para/cl:
Em/cl = (al/h)/(cl/h)
= 9/35.5
≈ 0,250 ou 1/4 (na verdade é 0,253)
Isto é, 0,250 g de Al reage com 1 g de CL para formar o sal correspondente. Mas, novamente, deve ser multiplicado para/Cl por um número que permite compará -lo (para conforto) com Al/H.
Impreciações no cálculo
Em seguida, é multiplicado em/cl por 108 (0,27/250), dando 27 g, dos quais reage com 108 g de cl. Isso não acontece precisamente. Se tomarmos, por exemplo, o valor de 0,253 por Al/Cl, e o multiplicamos por 106,7 (27/0,253), 27 g de Al reagem com 106,7 g de Cl; Que, ele se aproxima mais da realidade (Alcl3, com um PA de 35,5 g/mol para o CL).
Aqui observa -se como a lei de Richter pode começar a ser estagnada devido à precisão e uso indevido de decimais.
Referências
- Whitten, Davis, Peck e Stanley. (2008). Química. (8ª ed.). Cengage Learning.
- Flores, j. Química (2002). Santillana Editorial.
- Joaquín San Frutos Fernández. (s.F.). O peso e as leis volumétricas. Recuperado de: Encina.Pntic.Mec.é
- Toppr. (s.F.). Leis de combinação química. Recuperado de: TOPPR.com
- Brilhante. (2019). Leis de combinação química. Recuperado de: brilhante.org
- Química Librettexts. (15 de julho de 2015). Leis químicas fundamentais. Recuperado de: química.Librettexts.org
- Helmestine, Anne Marie, Ph.D. (18 de janeiro de 2019). Lei da conservação de massa. Recuperado de: pensamento.com
- « Conquista da descoberta, estágios, consequências da Colômbia
- 9 saídas de trabalho da carreira de administração de empresas »

