Estrutura da cápsula de Bowman, histologia, funções
- 1694
- 15
- Melvin Mueller
O Cápsula de Bowman Representa o segmento inicial do componente tubular do néfron, unidade anácomo-funcional do rim, na qual são realizados os processos destinados à produção de urina e com os quais o rim contribui para a conservação da homeostase do organismo do organismo.
Foi nomeado em homenagem ao oftalmologista inglês e médico anatomista Sir William Bowman, que descobriu sua existência e publica sua descrição histológica pela primeira vez em 1842.
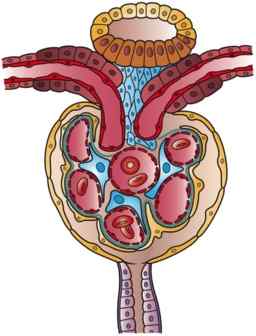
 Ilustração de um Nephron (fonte: obra de arte de Holly Fischer [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] via Wikimedia Commons)
Ilustração de um Nephron (fonte: obra de arte de Holly Fischer [CC por 3.0 (https: // CreativeCommons.Org/licenças/por/3.0)] via Wikimedia Commons) Há uma certa confusão na literatura em relação à nomenclatura dos segmentos iniciais do néfron, entre os quais a cápsula de Bowman está incluída. Às vezes é descrito como uma parte diferente do glomérulo e constituindo com ele o corpuscle renal, enquanto para outros tem uma função como membro do glomérulo.
Independentemente do fato de que, nas descrições anatômicas, a cápsula faz parte do glomérulo, o fato é que ambos os elementos estão tão intimamente associados em sua estrutura e função, que o termo glomerulus desperta em quem pensa a idéia de um esferito com seu embarcações.
Caso contrário, a cápsula seria simplesmente um receptáculo no qual o fluido filtrado no glomérulo é derramado, mas não teria parte no mesmo processo de filtração glomerular. O que não é assim, já que ela, como será visto, faz parte desse processo para o qual ela contribui de uma maneira especial.
[TOC]
Estrutura e histologia
A cápsula de Bowman é como uma pequena esfera cuja parede é invaginada no setor vascular. Nesta invaginação, a cápsula é penetrada pelo lanche de cabelo, que se origina na arteriola aferente e que traz sangue para o glomérulo, onde a arteriola eferente que leva o sangue do glomérulo também sai.
A extremidade oposta da cápsula, chamada pólo urinário, é apresentado como se a parede da esfera tivesse um buraco no qual o fim do primeiro segmento que começa a própria função tubular, ou seja, o túbulo com contorno proximal é conectado.
Esta parede externa da cápsula é um epitélio plano e é chamado de epitélio parietal da cápsula de Bowman. Altere a estrutura ao fazer a transição para o epitélio do túbulo proximal no pólo urinário e para o epitélio visceral no pólo vascular.
Pode atendê -lo: papilas fungiformesO epitélio invaggado é chamado visceral porque envolve os capilares glomerulares como se fossem uma víscera. É formado por células chamadas podócitos que abraçam, cobrindo -os, aos capilares e que têm características muito particulares.
Os podócitos são organizados em uma única camada, emitindo prolongamentos que interdemem com as extensões dos podócitos vizinhos, deixando espaços entre eles chamados poros em fendas ou fendas de filtração e que são soluções de continuidade para a etapa da filtragem.
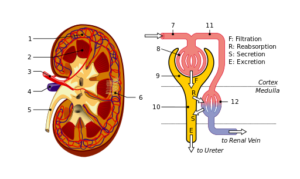 Estrutura de rim e néfron: 1. Córtex renal; 2. Medula; 3. Artéria renal; 4. Veias dos rins; 5. Ureter; 6. Néfrons; 7. Arteriola aferente; 8. Glomérulo; 9. Cápsula de Bowman; 10. Túbulos e Hanle Do; onze. Capilares peritubulares (Fonte: Arquivo: Physiology_Of_Nephron.SVG: MadHhero88File: Ridneysrurtures_piom.SVG: Piotr Michał Jaworski; PIOM em Plderivative Work: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Estrutura de rim e néfron: 1. Córtex renal; 2. Medula; 3. Artéria renal; 4. Veias dos rins; 5. Ureter; 6. Néfrons; 7. Arteriola aferente; 8. Glomérulo; 9. Cápsula de Bowman; 10. Túbulos e Hanle Do; onze. Capilares peritubulares (Fonte: Arquivo: Physiology_Of_Nephron.SVG: MadHhero88File: Ridneysrurtures_piom.SVG: Piotr Michał Jaworski; PIOM em Plderivative Work: Daniel Sachse (Antares42) [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Podócitos e células endoteliais que cobrem uma membrana basal na qual apóiam e também têm soluções de continuidade para a passagem de água e substâncias. As células endoteliais são fenestradras e também permitem filtração.
Portanto, esses três elementos: endotélio capilar, membrana basal e epitélio visceral da cápsula de Bowman, constituem a membrana ou a barreira de filtração juntos.
Funções
A cápsula está associada ao processo de filtração glomerular. Por um lado, porque faz parte da capa epitelial de podócitos que envolve os capilares glomerulares. Ele também contribui com a síntese da membrana basal na qual este epitélio e o endotélio capilar glomerular é suportado.
Essas três estruturas: endotélio capilar, membrana basal e epitélio visceral da cápsula de Bowman, constituem a membrana ou a barreira de filtração de mesmo.
Além disso, o volume de fluido que penetra no espaço do Bowman, juntamente com o grau de rigidez que a parede externa capsular se opõe, determina a gênese de uma pressão intracapsular que ajuda a modular a pressão efetiva de filtração e aumentar o líquido em todo o túbulo associado.
Pode servir a você: periósteo: características, funções e histologiaDeterminantes da magnitude da filtração glomerular
Uma variável que coleta a magnitude do processo de filtração glomerular é o volume de filtração glomerular chamado (VFG), que é o volume de líquido que é filtrado em todos os glomérulos na unidade do tempo. Seu valor normal médio é de cerca de 125 ml/min ou 180 l/dia.
A magnitude dessa variável é determinada do ponto de vista físico por dois fatores, a saber, o coeficiente de filtração ou ultrafiltração (KF) e a pressão efetiva da filtração (PEFF). Isto é: vfg = kf x peff (equação 1)
Coeficiente de filtração (KF)
O coeficiente de filtração (KF) é o produto da condutividade hidráulica (LP), que mede a permeabilidade da água de uma membrana em ml/min por unidade de área e unidade de pressão de implementação, pela área de superfície (a) da membrana do filtro, ou seja, kf = lp x a (equação 2).
A magnitude do coeficiente de filtragem indica o volume de fluido filtrado por unidade de tempo e por unidade de unidade efetiva. Embora seja muito difícil medir diretamente, ele pode ser obtido na Equação 1, dividindo o VFG/PEFF.
O KF nos capilares glomerulares é de 12,5 ml/min/mmHg por C/100g de tecido, valoriza cerca de 400 vezes maior que o KF de outros sistemas capilares do corpo, onde você pode filtrar cerca de 0,01 ml/min/mm Hg por 100 g de tecido. Comparação mostrando eficiência de filtragem glomerular.
Pressão de filtração eficaz (PEFF)
A pressão efetiva da filtração representa o resultado da soma algébrica das diferentes forças de pressão que favorecem ou se opõem à filtragem. Existe um gradiente de pressão hidrostático (ΔP) e outra pressão osmótica (oncótica, Δп) determinada pela presença de proteínas no plasma.
O gradiente de pressão hidrostático é a diferença de pressão entre o interior do capilar glomerular (PCG = 50 mm Hg) e o espaço da cápsula do Bowman (PCB = 12 mm Hg). Como visto, esse gradiente é direcionado do capilar para a cápsula e promove o deslocamento do fluido nesse sentido.
Pode atendê -lo: Esqueleto apendicular: funções e ossosO gradiente de pressão osmótica move líquido menor a maior pressão osmótica. Somente partículas que não filtram exercem esse efeito. Proteínas não filtram. Seu пcb é 0 e no capilar glomerular пcg é 20 mm hg. Este gradiente move líquido da cápsula para o capilar.
A pressão efetiva pode ser calculada aplicando PEFF = ΔP-δп; = (PCG-PCB)-(пCG-пCB); = (50-12)-(20-0); = 38-20 = 18 mm Hg. Existe, portanto, uma pressão de filtração eficaz ou líquida de cerca de 18 mm Hg que determina um VFG de cerca de 125 ml/min.
Índice de filtração (se) das substâncias presentes no plasma
É um indicador da facilidade (ou dificuldade) com a qual uma substância presente no plasma pode atravessar a barreira de filtração. O índice é obtido dividindo a concentração da substância em filtragem (FX) entre sua concentração no plasma (px), ou seja: ifx = fx/ px.
A faixa de valores IF está entre um máximo de 1 para as substâncias que filtram livremente e 0 para aqueles que não filtram nada. Os valores intermediários são para partículas com dificuldades intermediárias. Quanto mais próximo de 1 o valor, melhor a filtração. Mais perto de 0, mais difícil de filtrar.
Um dos fatores que determina o if é o tamanho da partícula. Aqueles que têm diâmetros inferiores a 4 nm filtro livremente (se = 1). À medida que o tamanho cresce e se aproxima do da albumina, o Fe é reduzido. Partículas de tamanho de albumina, ou maiores, têm 0 ses de 0.
Outro fator que ajuda a determinar o IF são cargas elétricas negativas na superfície molecular. As proteínas têm muita carga negativa, que é adicionada ao seu tamanho para impedir sua filtrabilidade. O motivo é que os poros têm cargas negativas que repelem as de proteínas.
Referências
- Ganong WF: Função renal e micção, em Revisão da fisiologia médica, 25ª ed. Nova York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JI: O sistema urinário, em Livro de fisiologia médica , 13ª ed, AC Guyton, Je Hall (eds). Filadélfia, Elsevier Inc., 2016.
- Lang F, Kurtz A: Niere, em Fisiográfico Physiologie des Menschen, 31º Ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Silbernagl S: Die Funkction der Nieren, em Fisiologia, 6ª ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Stahl Rak et al: Niere Undoitende Harnwege, em Fisiopatologia de Kllhenche, 8ª ed, W Siegenthaler (ed). Stuttgart, Georg Thieme Verlag, 2001.
- « O que são articulações fibrosas? Tipos e características
- BARAGONNOSIA Origem, conceito, teste, distúrbios relacionados »

