História da câmera Neubauer, características, usa

- 3987
- 89
- Ernesto Bruen
O Câmera Neubauer, Heatímetro ou hecocitômetro, é um instrumento de laboratório que consiste em uma placa de vidro especial. Esta câmara serve para realizar alguns tipos de células, como glóbulos vermelhos, glóbulos brancos e plaquetas, embora possam ser usados para contar esporos, espermatozóides, parasitas, etc.
Apresenta características muito peculiares, pois consiste em 3 zonas, uma central para a contagem e duas zonas de suporte. Cada câmera tem duas áreas de contagem ou retículos, um na parte superior e outro na parte inferior.
 Câmera Neubauer. Fonte: Santibadia [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Imagem editada.
Câmera Neubauer. Fonte: Santibadia [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]. Imagem editada. Estes têm várias divisões em forma de grade. As áreas de contagem são as caixas médias encontradas nos 4 cantos de ambos os retículos, além da praça central.
A montagem da câmera deve ser feita com muito cuidado, pois qualquer detalhe influencia a contagem de células. Existem muitos erros que podem ser cometidos, mas se ocorrer algum deles, a câmera deve ser desmontada, limpa e re -reunida. Entre os principais erros, o seguinte pode ser mencionado:
Rebosar a câmera ou fazer um recheio insuficiente, deixe a câmera secar, tentar remover o excesso de fluido com gaze, inclinar a câmera transportando -a, enchendo uma câmera suja ou úmida, não misturando a diluição ou bem a amostra, entre outros. Todos esses erros resultarão em um valor irreal.
[TOC]
História
A câmera de Neubauer é um instrumento de precisão e, no processo de fabricação, passa por um controle rigoroso de qualidade. Foi criado para partículas ou formas precisas por mm3, como células em vários líquidos. Seus gráficos delicados são esculpidos com lápis de diamante.
Características da Câmara de Neubauer
A câmera completa é do tamanho de um slide normal para que possa ser colocado na placa do microscópio.
A câmera consiste em três superfícies retangulares centrais (a, b, c). Na zona “B”, a zona R ou de contagem está localizada, também chamada de reticulum. Um de cada lado da câmera, separado pela zona “D”.
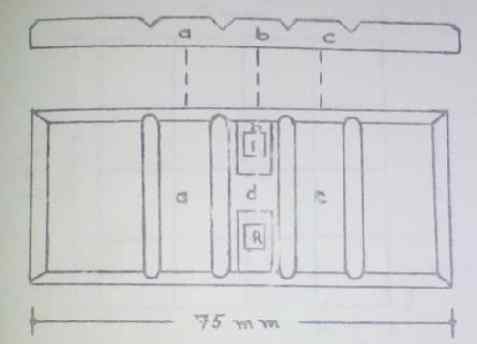 Esquema gráfico da câmera Neubauer. Fonte: Guia Prático de Hematologia. Escola de Bioanalisia da Universidade de Carabobo, Venezuela.
Esquema gráfico da câmera Neubauer. Fonte: Guia Prático de Hematologia. Escola de Bioanalisia da Universidade de Carabobo, Venezuela. Cada retículo é uma área polida que contém a área de contribuição gravada. Consiste em um quadrado com uma área de 9 mm2 E é dividido internamente em 9 fotos com 1 mm2 superfície. Os quatro cantos são divididos em 16 grades menores (0.0625 mm2 De superfície).
Essas grades são formadas por uma série de linhas de milímetro que se cruzam entre si, constituindo grades perfeitamente gráficas e delimitadas para as medidas especificadas. Essas linhas foram gravadas com dica de diamante.
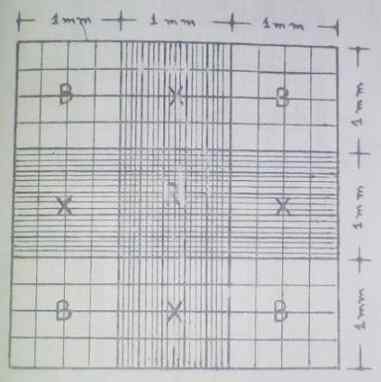 Retículo de Neubauer aprimorado. Fonte: Guia de Hematologia Prática da Escola de Bioanalisia da Universidade de Carabobo, Venezuela.
Retículo de Neubauer aprimorado. Fonte: Guia de Hematologia Prática da Escola de Bioanalisia da Universidade de Carabobo, Venezuela. Os quatro lados correspondem à área de contagem. Nesses lados ou cantos, é onde é realizado a conta da maioria das células (glóbulos vermelhos e leucócitos), enquanto as plaquetas são contadas na área central.
Pode servir a você: verde malaquita: características, preparação, aplicações, toxicidadeA zona central tem mais divisões, consiste em um quadrado de 1 mm2 dividido em 25 pinturas que têm uma área de 0,04 mm2 cada um. Por sua vez, estes são divididos em 16 grades com uma área de 0,0025 mm2.
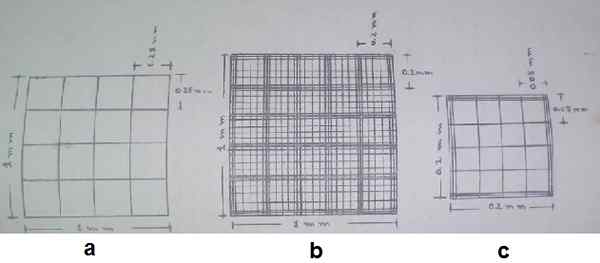 Descrição do retículo Neubauer aprimorado. a) quadrado dos cantos, b) quadrado central, c) quadrado médio da praça central. Fonte: Guia de Hematologia Prática da Escola de Bioanalisia da Universidade de Carabobo, Venezuela.
Descrição do retículo Neubauer aprimorado. a) quadrado dos cantos, b) quadrado central, c) quadrado médio da praça central. Fonte: Guia de Hematologia Prática da Escola de Bioanalisia da Universidade de Carabobo, Venezuela. A área "A" e "C" serve como suporte para colocar um objeto especial chamado lamela hematimétrica ou tampas de hematímetro.
A altura entre a lamela e a superfície de contagem é de 0,1 mm. As medidas de superfície das caixas de contagem, bem como a altura da câmera e a diluição da amostra, são dados necessários para executar os cálculos finais.
Formulários
É usado para contagem de células. Especialmente é muito útil na área de hematologia, pois permite que as três séries de células sanguíneas sejam feitas; isto é, glóbulos vermelhos, glóbulos brancos e plaquetas.
No entanto, pode ser usado em outras áreas, por exemplo, para contar espermatozóides, esporos, bactérias ou outros elementos importantes, dependendo do tipo de amostra.
Como se usa?
Preparação de amostra
Para realizar a contagem de células, geralmente começa a partir de uma diluição anterior. Exemplo: Para contar os glóbulos brancos, uma diluição de 1:20 é preparada com líquido turco. A diluição está bem misturada antes de carregar a pipeta e configurar a câmera Neubauer.
Há ocasiões em que uma diluição de 1:20 não é suficiente para contar. Por exemplo, em pacientes que sofrem de certos tipos de leucemias crônicas. Nesses casos, diluições mais altas devem ser feitas como 1: 100.
Se, pelo contrário, a conta é muito baixa, como em leucopenias graves, diluições menores podem ser feitas para concentrar a amostra. Exemplo: você pode fazer uma diluição 1:10.
As mudanças que são feitas influenciam os cálculos.
Assembléia da câmara de Neubauer
A Câmara de Neubauer é montada colocando a lamela hematimétrica na zona central. Ambos devem ser muito limpos e secos. Para colocar a lamela, ele é levado pelas bordas e cai suavemente na câmera.
Isso é preenchido colocando a ponta de uma pipeta automática ou pipeta Thoma em um ângulo de 35 ° na borda da área de carga. O líquido é descarregado suavemente e a zona de carregamento é preenchida por capilaridade. Isso é feito de ambos os lados para carregar os dois retículos.
Nenhum retículo não deve ser sobrecarregado e o líquido não deve ser negado. A carga deve ser exata. É importante que o recheio seja feito homogeneamente, ou seja, não deve haver bolhas.
Uma vez que a câmera está em repouso por 2 minutos para as células precipitarem em segundo plano e sua visualização e contagem é mais fácil.
Após o tempo de descanso, é montado na luz do microscópio de luz para observação. Primeiro, ele se concentra com um objetivo de 10x e, se necessário, é passado para 40x.
Pode servir você: lacuna ânionPara melhorar sua visualização, a luz do microscópio é reduzida. Para fazer isso, o condensador é reduzido e o diafragma fecha um pouco.
Conta
Para a conta dos glóbulos brancos ou leucócitos, toda a superfície dos quatro quadrados médios dos cantos e o quadrado central de cada retículo devem ser contados.
A contagem começa no quadrado do canto superior esquerdo. Começa a partir do primeiro quadrado da primeira fila, isto é, da esquerda para a direita para chegar ao extremo oposto.
Lá é abaixado e a aparência é devolvida da direita para a esquerda até chegar à outra extremidade e assim por diante, nas células dentro de cada grade na forma de zigue -zague. As 16 grades de cada quadrado médio são contadas.
Para evitar contar uma célula duas vezes, existem regras nas células localizadas nas linhas fronteiriças de cada grade. As células que estão localizadas na esquerda e as linhas superiores são contadas e as que estão localizadas nas linhas direito e inferior são ignoradas.
Um contador de células manuais deve estar disponível para que o operador oprime a chave do dispositivo quantas vezes. Com o uso do contador, o operador pode contar sem a necessidade de procurar para cima do campo microscópico. No final da conta, você observará o número total de células contadas.
Cálculos
Para cálculos, você pode prosseguir de várias maneiras. Você pode contar um único retículo ou ambos podem ser contados e uma média de ambos. Nessas duas situações, as células contadas devem ser multiplicadas por um fator, que neste caso seria 40. E assim a contagem total por mm é obtida3.
Mas se os dois retículos forem contados e não houver média, ele deve ser multiplicado por um fator diferente, neste caso até 20.
-Fator de multiplicação
Em seguida, o fator de multiplicação é calculado.
Para os cálculos, vários dados são levados em consideração, incluindo o título da diluição, a altura da câmara e a superfície contada.
Diluição
A diluição usada de maneira padrão é 1:20 para a contagem de leucócitos.
Altura da câmara
A altura entre a câmera e a lâmina hematimétrica é de 0,1 mm.
Superfície contada
Se 5 quadrados de 1 mm são contados2 superfície, significa que a conta total da contagem é de 5 mm2. Esses dados devem ser multiplicados pela altura da câmera para obter o volume total informado. Isto é, 5 mm2 x 0,1 mm = 0,5 mm3.
Fórmulas e cálculos
Com os dados que se dizem, diz -se:
Se a 0,5 mm3 -Existem ° de células contadas
Em 1 mm3 --Haverá - X número de células
X célula n ° = (n ° de células caladas x 1) /0,5 mm3
Mas a diluição também deve ser levada em consideração. Portanto, a fórmula é a seguinte:
(N ° de células contadas x 1) x 20/0,5 mm3
Finalmente, para resumir, você pode multiplicar o número de células contadas por 40. Assim, o valor dos leucócitos por mm é obtido3.
Pode servir a você: Osmose: processo, tipos, diferenças com difusão e exemplosCaso os dois retículos sejam contados, os dados são alterados que, neste caso, seria de 10 quadrados, ou seja, 10 mm2. E um volume total informado de 1 mm3. A fórmula permaneceria:
(N ° de células contadas x 1) x 20/1 mm3
Portanto, neste caso, o fator de multiplicação seria 20.
Erros
-Se ao carregar a câmera, ela for excedida ou excedida com fluido, a altura da câmera varia. Isso resulta na contagem do real. Se você tentar remover o excesso de gaze ou algodão, isso representa um erro de carafal. Esta ação fará com que as células se concentrem, aumentando a contagem.
-Se for mal cobrado, a contagem será sob o real.
-No caso de a câmera ser montada e soltada, não é mais possível fazer a contagem, porque transmitirá resultados errôneos.
-Se antes de carregar a câmera, a diluição da amostra não estiver bem misturada, há um risco de erro de leitura, pois as células não serão distribuídas homogeneamente. Portanto, haverá menos ou maior concentração de células, dependendo de a amostra ser retirada da superfície do líquido ou do fundo do tubo, respectivamente.
-A presença de bolhas diminui a quantidade de líquido que deve entrar no retículo, interferindo na visualização e distribuição corretas das células. Tudo isso afeta significativamente os resultados.
-Durante a contagem, não levante o microscópio até que cada quadrado grande seja concluído para evitar se perder.
-Um motivo de erro é curvar a câmera após montada. Portanto, você deve enviar cuidadosamente a placa do microscópio.
Recomendação
Se, por algum motivo.
Tenha muito cuidado ao limpar a câmera para evitar o arranhão dos retículos. Por outro lado, lembre -se de que a lamel hematimétrica é delicada e frágil. A manipulação inadequada pode quebrá -la.
Antes de começar a contar, verifique se as células foram bem distribuídas. Uma distribuição desigual de células ocorre por uma má mistura da amostra ou diluição. Se isso acontecer, a assembléia deve ser repetida.
Uma maneira de saber se as células estão bem distribuídas está comparando a conta de cada quadrado grande, o número de células contadas por cada quadrado não deve ser exageradamente diferente entre um e o outro.
-Se o glóbulo branco contabilizar mais de 50.000 mm3 É aconselhável repetir a conta, fazendo uma diluição maior.
-Se ele modificar a diluição, o fator de multiplicação deve calcular novamente, pois isso influencia a fórmula.
Referências
- Cardona-Maya W, Berdugo J, Cadavid A. Comparação da concentração de esperma usando a câmera de Makler e a câmera de Neubauer. Urol esp 2008; 32 (4): 443-445. Disponível em: Scielo.
- Câmera Neubauer. (2018, 27 de março). Wikipedia, enciclopédia livre. Data da consulta: 04:10, 23 de junho de 2019 de ES.Wikipedia.org
- Meneses A, Rojas L, Sifontes S. Aplicação de um método de contagem alternativo na câmara de Neubauer para determinar a concentração de vaginalis trichomonas. Rev. Cub Med Trop 2001; 53 (3): 180-8. Disponível em: ResearchGate.líquido
- Gómez-Pérez Roald e. Análise de Expermograma. Rev. Venez. Endocrinol. Metab. 2007; 5 (2): 19-20. Disponível em: VE.Scielo
- Guia de Hematologia Prática da Escola de Bioanalisia da Universidade de Carabobo. Venezuela.1998
- « Aspectos positivos ou negativos presentes na democratização do conhecimento
- Aspecto mais importante da pequena ciência, grande ciência e tecnociência »

