Estrutura de clorito de sódio (Naclo2), propriedades, usos, riscos

- 2120
- 364
- Alfred Kub
Ele Clorito de sódio É um sólido inorgânico formado por um Íon Sodium na+ e um clorito de íons clo2-. Sua fórmula química é Naclo2. É um sólido branco cristalino, além de ser um forte agente oxidante. Portanto, deve ter muito cuidado.
Seu principal uso é como um agente desinfetante para muitos aplicativos. Ele permite eliminar micróbios em superfícies como pisos, paredes e equipamentos de laboratório em hospitais e clínicas e em seus sistemas de água.
 Naclo de clorito de sódio2 sólido. Autor: Chemicalintest . Fonte: Wikimedia Commons.
Naclo de clorito de sódio2 sólido. Autor: Chemicalintest . Fonte: Wikimedia Commons. Também em instalações agrícolas e veterinárias, para higienizar incubadoras de ovos de pássaros, controlar infecções de vacas leiteiras, desinfetar sistemas de água para animais, etc.
Na indústria de alimentos, suas soluções aquosas acidificadas servem para lavar carne, galinhas, frutas, vegetais e o equipamento de tais instalações.
Com clorito de sódio, o dióxido de cloro pode ser preparado2 No local de uso, que permite eliminar micróbios, maus odores e sabores de água para que seja agradável e possa beber sem problemas.
Ele também serve para polpa de papel de água sanitária, fibras têxteis vegetais e óleos, entre outras aplicações.
O naclo2 sólido deve ser tratado com cautela, porque em contato com certas explosões de materiais podem ocorrer. Suas soluções são um pouco mais fáceis de manipular, mas são muito oxidantes e corrosivas.
[TOC]
Estrutura
O clorito de sódio é composto de um cátion de sódio+ e um clorito ânion clo2- Portanto, eles estão unidos por um vínculo iônico.
O ânion clorito tem um átomo de cloro em um estado de oxidação de +3 e dois átomos de oxigênio com valência -2 cada. Por esse motivo, o ânion clorito tem um fardo negativo.
Ele também tem uma estrutura em forma de ângulo.
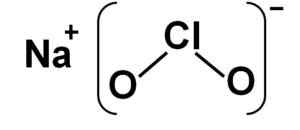 Estrutura de clorito de sódio naclo2. Autor: Marilú Stea.
Estrutura de clorito de sódio naclo2. Autor: Marilú Stea. Nomenclatura
- Clorito de sódio
- Clorito de sódio
- Sal de sódio de cloro
Propriedades
Estado físico
Sólido branco cristalino.
Peso molecular
90,44 g/mol.
Ponto de fusão
Se decompõe à medida que derrete entre 180 e 200 ºC.
Densidade
2.468 g/cm3
Solubilidade
Solúvel em água: 64 g/100 g de água a 17 ºC. Ligeiramente solúvel em metanol.
Outras propriedades
É um pouco higroscópico.
É um forte agente oxidante. Reage violentamente com materiais e redutores combustíveis. Reage violentamente com ácidos, gerando dióxido de cloro clo2.
Pode atendê-lo: regras Hume-RotherySuas soluções alcalinas (significa na presença de, por exemplo, Naoh) são bastante estáveis, enquanto em meio ácido o cloro ácido hclo é formado2, que se decompõe rapidamente:
4 HCLO2 → 2 clo2↑ + clo3- + Cl- + 2 h+ + H2QUALQUER
Riscos
Ambos Naclo2 sólidos como suas soluções aquosas são potencialmente perigosas e requerem muita cautela e experiência durante sua manipulação e armazenamento.
O naclo2 Solid pode explodir ao entrar em contato com substâncias orgânicas, incluindo luvas e roupas, materiais de controle de derramamentos, como serragem e algodão residual, além de óleos e gorduras.
A forma sólida é, portanto, muito difícil de transportar e é preferível usá -lo na forma de soluções aquosas.
Essas soluções são extremamente corrosivas. Eles devem preferencialmente manter um pH acima de 8, ou seja, um pH alcalino.
O naclo2 acelera a combustão de compostos ou materiais inflamáveis, a ponto de poder formar misturas explosivas com estes.
Se aquecida, emite fumaça tóxica de ácido clorídrico HCl e óxido de sódio na2QUALQUER. Se for prolongado prolongado para aquecer ou disparar, pode explorar.
Obtenção
É preparado começando com a redução química ou eletroquímica do sodio naclo3, Na presença de ácido clorídrico HCl para produzir dióxido de cloro clo2.
Este último está reagindo com peróxido de hidrogênio H2QUALQUER2 Na solução aquosa de hidróxido de sódio NaOH e uma solução de clorito de sódio é obtida2, que evapora e cristaliza o sólido.
Também pode ser obtido pela passagem de gás de dióxido de cloro2 Para uma solução de NaOH.
2 clo2 + 2 Naoh → Naclo2 + Naclo3 + H2QUALQUER
Formulários
Como microbicida e desinfetante em várias aplicações
É um ingrediente de numerosos produtos que servem para controlar bactérias, fungos e lodo ou lodo de algas. Os produtos que o contêm para esse fim são usados em agricultura, comércio, indústria e residências ou casas.
Serve como um desinfetante de muitos tipos de materiais e superfícies.
Na agricultura, aves e indústrias similares são superfícies duras desinfetadas, equipamentos, instalações para a incubação de ovos de pássaros, estufas para fungos, como cogumelos e sistemas de água e água de resfriamento para canetas de aves.
Possui uso veterinário como um desinfetante tópico no controle da mastite de gado leiteiro, para mergulhar os mamilos do animal. Mastite é uma infecção de vacas.
Pode servir a você: processo adiabático: tipos, exemplos, exercícios resolvidos Às vezes você tem que mergulhar vacas em soluções de clorito de sódio para evitar infecções. Autor: Hans Braxmeier. Fonte: Pixabay.
Às vezes você tem que mergulhar vacas em soluções de clorito de sódio para evitar infecções. Autor: Hans Braxmeier. Fonte: Pixabay. Também é usado em estabelecimentos de pesquisa natural para descontaminar laboratórios.
Os usos comerciais, industriais e médicos incluem desinfetar sistemas de ventilação, superfícies duras (como pisos, paredes, equipamentos de laboratório) e sistemas de água.
Em instalações de saúde, como clínicas e hospitais, é usado para descontaminar quartos, corredores, áreas de isolamento e esterilização material.
Também é útil para higienizar os estabelecimentos onde as pessoas sofrem tratamentos de saúde de água ou spa.
Na indústria de alimentos, é usado como fumigante para conservar alimentos.
É usado na forma de clorito de sódio acidificado. Isso é produzido adicionando ácido alimentar (por exemplo, ácido cítrico, ácido fosfórico, ácido da roda ou sulfato de ácido de sódio) a uma solução aquosa de clorito de sódio.
O clorito de sódio acidificado possui propriedades antimicrobianas e é usado como uma solução de lavagem de orvalho ou frango ou imersão, carne, legumes, frutas e produtos marinhos. Também em água para congelar frango ou pássaros.
Nas famílias, permite desinfetar superfícies duras, como pisos e banheiros, sistemas de aquecimento ou ar condicionado e sistemas de circulação de água da piscina.
 Para desinfetar piscinas, você pode usar naclo de clorito de sódio2. Autor: Age Global Group. Fonte: Pixabay.
Para desinfetar piscinas, você pode usar naclo de clorito de sódio2. Autor: Age Global Group. Fonte: Pixabay.  Produtos que contêm clorito de sódio permitem banheiros banheiros. Autor: Michal Jarmoluk. Fonte: Pixabay.
Produtos que contêm clorito de sódio permitem banheiros banheiros. Autor: Michal Jarmoluk. Fonte: Pixabay. Também é vendido em pequenas saquetas, juntamente com outros compostos para liberar cheiros de gás e controle em casas.
Para desinfetar água potável
É usado na purificação da água para beber, atua como um oxidante, melhorando o sabor e o cheiro da água potável.
O clorito de sódio é amplamente utilizado como precursor para a geração de dióxido de cloro clo2 que serve para tratar a água potável para o consumo humano, isto é, para eliminar microorganismos, odores e sabores desagradáveis e pode beber.
Para gerar clo2 HCl pode ser usado:
5 NACLO2 + 4 hcl → 4 clo2↑ + 5 NaCl + 2 h2QUALQUER
O clo2 É um agente antimicrobiano de alta ação oxidante e amplo espectro. Isto é, age contra um grande número de microorganismos.
Pode atendê -lo: nitrito de potássio (KNO2): estrutura, propriedades e usosOs microorganismos são desativados porque o CLO2 interfere em enzimas importantes destas e com proteínas das membranas celulares. Ele também tem a vantagem de não produzir compostos organoclorados, que são tóxicos.
Existem comprimidos de clorito de sódio à venda misturados com outros compostos que são dissolvidos na água e produzem imediatamente o clo2 de maneira controlada, desinfetando a água.
 O clorito de sódio é usado com outros compostos para obter água potável pronta para beber. Autor: Ulrike Leone. Fonte: Pixabay.
O clorito de sódio é usado com outros compostos para obter água potável pronta para beber. Autor: Ulrike Leone. Fonte: Pixabay. O principal problema de tratar a água para remover sabores e cheiros através de clo2 Consiste em que os sais tóxicos de clorito e cloro podem ser formados durante o tratamento.
Para atendimento de lentes de contato
O naclo2 É um componente das soluções usadas para desinfetar as lentes de contato.
Uma combinação de naclo é usada2 e traços (quantidades muito pequenas) de peróxido de hidrogênio H2QUALQUER2.
O h2QUALQUER2 Estabilize o clo2 Isso é formado e a combinação de ambos é muito eficaz contra bactérias, fungos e leveduras. Os produtos que são então são cloreto de sódio, água e oxigênio, que são inofensivos, o que significa que eles não são prejudiciais aos olhos.
Quando as lentes são removidas da solução, Naclo2 residual se decompõe rapidamente em Nall e O2. Peróxido residual não irrita o olho. Portanto, essas soluções são muito seguras.
 As soluções para desinfetar as lentes de contato têm clorito de sódio entre seus ingredientes. Autor: Nieuw ~ Commonswiki. Fonte: Wikimedia Commons.
As soluções para desinfetar as lentes de contato têm clorito de sódio entre seus ingredientes. Autor: Nieuw ~ Commonswiki. Fonte: Wikimedia Commons. Em várias aplicações
O clorito de sódio é usado para preparação de dióxido de cloro2 Para uso imediato em um grande número de aplicações das quais alguns foram tratados em parágrafos anteriores.
Serve para polpa de madeira branqueada, têxteis como algodão, fibras de plantas, óleos comestíveis e não comestíveis, gorduras, vernizes, lacas e ceras.
É um componente de colírios e algumas soluções para lavagem oral.
É usado na indústria de processamento de couro e em agentes para eletrodo de metal (revestimento de metal).
Referências
- Williams, l. et al. (2019). Microbiologia, cuidados com lentes e manutenção. Nas lentes de contato (sexta edição). Recuperado de cientedirect.com.
- OU.S. Biblioteca Nacional de Medicina. (2019). Clorito de sódio. Recuperado de PubChem.NCBI.Nlm.NIH.Gov.
- Cinza, n.F. (2014). Dióxido de cloro. Processo tecnológico. Em Microbiologia de doenças aquáticas (segunda edição). Recuperado de cientedirect.com.
- McKen, l. (2012). Introdução à radição de alimentos e esterilização médica. Dióxido de cloro. No efeito da esterilização em plástico e elastômeros (terceira edição). Recuperado de cientedirect.com.
- Ortenberg, e. e Telsch, B. (2003). Problemas de sabor e odor em água potável. No Manual de Microbiologia de Água e Águas Residuais. Recuperado de cientedirect.com.
- Karsa, d.R. (2007). Biocidas. Dióxido de cloro. No manual para limpeza/descontaminação de superfícies. Recuperado de cientedirect.com.
- Algodão, f. Albert e Wilkinson, Geoffrey. (1980). Química inorgânica avançada. Quarta edição. John Wiley & Sons.
- Enciclopédia de química industrial de Ullmann. (1990). QUINTA EDIÇÃO. Vch verlagsgellschaft mbh.

