Ácido sulfuroso
- 957
- 212
- Mr. Reginald Lindgren
 O ácido sulfuroso é um ácido mineral que ocorre quando o dióxido de enxofre se dissolve na água
O ácido sulfuroso é um ácido mineral que ocorre quando o dióxido de enxofre se dissolve na água O que é ácido sulfuroso?
Ele Ácido sulfuroso É um oxácido que se forma quando dióxido de enxofre, então2, dissolve -se na água. É um ácido inorgânico fraco e instável, que não pôde ser detectado em solução, uma vez que a reação de sua formação é reversível e o ácido se decompõe rapidamente nos reagentes que o produziram (então2 e h₂o).
É um líquido incolor, com um forte cheiro de enxofre, instável e é usado em vários campos industriais, como materiais manchados de cloro, para a síntese de produtos medicinais e químicos, para fabricação de papel ou para refinar derivados do petróleo.
A molécula de ácido em enxofre no momento foi detectada apenas na fase gasosa. As bases conjugadas desse ácido são ânions comuns sob as formas de sulfitos e bissulfito.
Espectro de Raman de SO Solutions2 Ele só mostra sinais devido à molécula SO2 e íon bissulfito, HSO3-, consistente com o seguinte saldo:
SW2 + H₂o hso3- + H+
Isso indica que, pelo espectro de Raman, não é possível.
Quando exposto à atmosfera, ela é rapidamente transformada em ácido sulfúrico. O ácido sulfuroso é reduzido ao sulfeto de hidrogênio devido à ação do ácido sulfúrico diluído e zinco.
A tentativa de concentrar uma solução SO2 Por evaporação da água para obter ácido de enxofre sem água, não produziu um resultado, uma vez que o ácido se decompõe rapidamente (investindo a reação de formação), de modo que o ácido não pode ser isolado.
Estrutura de Ácido sulfuroso
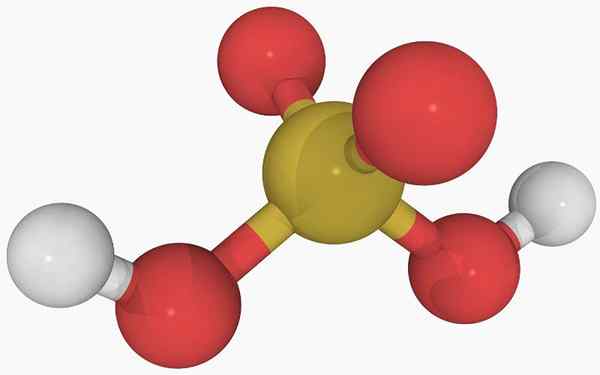
 Estrutura química do ácido sulfuroso
Estrutura química do ácido sulfuroso Na imagem principal, a estrutura de uma molécula isolada de ácido sulfuroso em um estado gasoso pode ser visto. A esfera amarela no centro corresponde ao átomo de enxofre, os vermelhos a átomos de oxigênio e branco para hidrogênios.
Pode atendê -lo: DIRETEOMERSSua geometria molecular em torno do átomo S é pirâmide trigonal, com os átomos de ou desenhando a base.
Então, no estado gasoso, as moléculas H2SW3 Eles podem ser considerados como pirâmides trigonais microscópicos flutuando no ar, assumindo que eles estão estáveis o suficiente para durar algum tempo sem reagir.
A estrutura deixa claro de onde vêm os dois hidrogênios ácidos: a partir dos grupos hidroxila ligados ao enxofre, ho-oh-oh. Portanto, para este composto, não é correto assumir que um dos prótons ácidos, h+, é liberado do átomo de enxofre, h-so2(OH).
Os dois grupos OH permitem que o ácido do enxofre interaja usando pontes de hidrogênio, e também o oxigênio da ligação S = O é um aceitador de hidrogênio, o que faz h2SW3 tanto em um bom doador quanto aceitador dessas pontes.
De acordo com o exposto, H2SW3 Eu deveria ser capaz de se condensar em um líquido, como o ácido sulfúrico, h2SW4. No entanto, não é assim que acontece.
Propriedades físicas e químicas do Ácido sulfuroso
Fórmula molecular
H2SW3
Peso molecular
82.073 g/mol.
Aspecto físico
É um líquido incolor, com um cheiro picante de enxofre.
Densidade
1.03 g/ml.
Densidade de vapor
2.3 (em relação ao ar tomado como 1)
Corrosividade
É corrosivo para metais e tecidos.
Solubilidade em água
Miscível.
Sensibilidade
É sensível ao ar.
Estabilidade
Estável, mas incompatível com bases fortes.
Constante de acidez (ka)
1.54 x 10-2
Pka
1.81
ph
1.5 na escala de pH.
ponto de ignição
Não inflamável.
Decomposição
Quando aquecido, o ácido de enxofre pode ser quebrado, emitindo uma fumaça tóxica de óxido de enxofre.
Pode servir a você: hidróxido de cromo: estrutura, propriedades, síntese, usosNomenclatura
O enxofre tem as seguintes valências: ± 2, +4 e +6. Da fórmula h2SW3, Pode ser calculado qual valência ou número de oxidação tem enxofre no composto. Para fazer isso, basta resolver uma soma algébrica:
2 (+1) + 1v + 3 (-2) = 0
Como é um composto neutro, a soma das cargas dos átomos que constituem deve ser 0. Limpando V Para a equação anterior, você tem:
V = (6-2)/1
Assim, v é igual a +4. Ou seja, o enxofre participa de sua segunda Valência e, de acordo com a nomenclatura tradicional, o sufixo deve ser adicionado ao nome -ooso. Por esse motivo, para H2SW3 É conhecido como ácido de enxofreurso.
Outra maneira mais rápida de determinar esta valência é comparar H2SW3 com h2SW4.
Em h2SW4 O enxofre tem Valência +6; portanto, se um ou, Valencia descer para +4 e, se outro for removido, Valencia descerá para +2 (o que seria o caso do ácido soluçoEnxofreurso, H2SW2).
Embora menos conhecido, para H2SW3 Também pode ser chamado de ácido trioxosulfúrico (IV), de acordo com a nomenclatura de ações.
Formação de ácido sulfuroso na natureza
O ácido sulfuroso é formado na natureza devido à combinação de dióxido de enxofre, produto da atividade de grandes fábricas, com água atmosférica.
Por esse motivo, é considerado um produto intermediário da chuva ácida, causando grandes danos à agricultura e ao meio ambiente.
Síntese
Tecnicamente, o enxofre é formado para formar dióxido de enxofre. Então, ele se dissolve na água para formar ácido de enxofre. No entanto, a reação é reversível e o ácido se decompõe rapidamente nos reagentes.
Esta é uma explicação de por que o ácido de enxofre não é encontrado em solução aquosa (como já mencionado na seção de sua estrutura química).
Pode atendê-lo: Lei de Beer-LambeFormulários
Geralmente, os usos e aplicações de ácido sulfuroso, uma vez que sua presença não pode ser detectada, consulte os usos e aplicações de dióxidos de enxofre e a base e sais de ácido.
Em madeira
No processo de sulfita, a polpa de madeira na forma de fibras de celulose quase pura ocorre. Vários sais de ácido de enxofre são usados para a extração de lignina de lascas de madeira, usando recipientes de alta pressão chamados digestores.
Agente desinfetante
O ácido sulfuroso é usado como desinfetante.
Água sanitária
Também é usado como um branqueamento suave, especialmente para materiais sensíveis ao cloro. Além disso, é usado como alvejante dental e aditivo alimentar.
Cosméticos
É um ingrediente de vários cosméticos para cuidados com a pele e foi usado como um elemento pesticida na eliminação de ratos. Elimina manchas causadas por vinho ou frutas em diferentes tecidos.
Antisséptico
Serve como anti -séptico, sendo eficaz para evitar infecções de pele. Em alguns momentos, foi usado em fumigações para desinfetar navios, pertences de vítimas de epidemias, etc.
Agente conservante
O ácido de enxofre é usado como conservante de frutas e vegetais e para evitar a fermentação de bebidas como vinho e cerveja, sendo um elemento antioxidante, antibacteriano e fungicida.
Produtos quimicos
O ácido sulfuroso é usado na síntese de medicamentos e produtos químicos, na elaboração de vinho e cerveja, no refinamento de produtos derivados de óleo e como reagente analítico.
Referências
- Nomenclatura de ácidos. Recuperado de 2.Química.Gatech.Edu
- Calvo Flores, f. G. Formulação química inorgânica. UGR recuperou.é

