Ácido fosfórico (H3po4)
- 2449
- 103
- Mr. Reginald Lindgren
 Molécula de ácido fosfórico individual
Molécula de ácido fosfórico individual O que é ácido fosfórico?
Ele ácido fosfórico É um ácido oxo do fósforo que tem uma fórmula química H3Po4. Consiste em um ácido mineral no qual três prótons ácidos estão ligados ao ânion fosfato (PO43-). Embora não seja considerado um ácido forte, seu uso inadequado pode ter um risco à saúde.
Pode ser encontrado em dois estados: como um sólido na forma de grossos cristais ortorrômbicos, ou como um líquido com aparência de xarope cristalina. Sua apresentação comercial mais usual tem uma concentração de 85% P/P e uma densidade de 1.685 g/cm3. Esta densidade vem da mão da concentração.
Os três grupos de OH são responsáveis por doar hidrogênios ácidos. Devido à presença deles em sua estrutura, você pode reagir com diferentes hidróxidos causando vários sais.
No caso de hidróxido de sódio, você pode formar três: fosfato de sódio monobásico (Nah2Po4), Fosfato de sódio dibásico (NA2HPO4) e fosfato de sódio tribásico (NA3Po4).
No entanto, dependendo de qual base é usada para neutralização, ou quais cátions estão muito próximos, você pode formar outros sais de fosfato. Entre eles estão: fosfato de cálcio (CA3(Po4)2), Fosfato de lítio (Li3Po4), fosfato férrico (FEPO4), as outras. Cada um com seus diferentes graus de protonação do ânion fosfato.
Por outro lado, o ácido fosfórico pode "sequestrar" cátions divalentes como a fé2+, Cu2+, AC2+ e mg2+. Em altas temperaturas, você pode reagir consigo mesmo com a perda de uma molécula H2Ou formação de diâmetros, aparadores e polímeros de ácidos fosfóricos.
Esse tipo de reação torna esse composto capaz de estabelecer um grande número de estruturas com esqueletos de fósforo e oxigênio, a partir do qual uma grande variedade de sais conhecidos também pode ser obtida, como polifosfatos.
Em relação à sua descoberta, ele foi sintetizado em 1694 por Robert Boyle (1627-1691), dissolvendo P2QUALQUER5 (Pentóxido de fósforo) na água. É um dos ácidos minerais mais úteis, sendo sua função como fertilizante, o mais importante.
Fósforo, potássio e nitrogênio constituem os três principais nutrientes das plantas.
Estrutura de ácido fosfórico químico
 Estrutura de ácido fosfórico químico
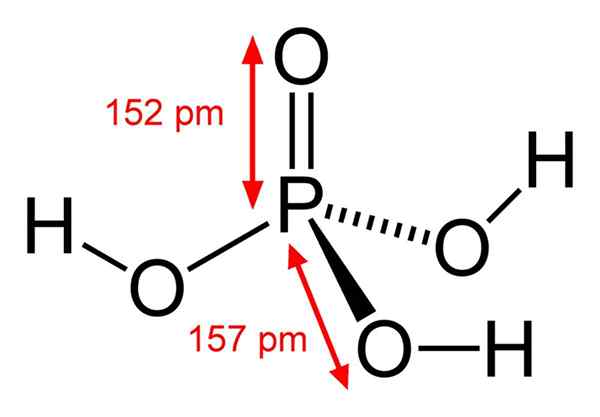
Estrutura de ácido fosfórico químico O ácido fosfórico consiste em uma ligação P = O. Com o átomo de fósforo no centro, o oxigênio desenha uma espécie de tetraedro molecular.
Dessa maneira, o ácido fosfórico pode ser visualizado como um tetraedro. Nesta perspectiva, esses tetraedros (por h unidades3Po4) interagir entre si por pontes de hidrogênio; isto é, seus vértices se aproximam de perto.
Essas interações intermoleculares permitem o ácido fosfórico cristalico em dois sólidos: anidro e hemi -hidrato (H3Po4· 1/2h2O), ambos com sistemas cristalinos monoclínicos. Sua forma de Anhydra também pode ser descrita com a fórmula: 3h2Ou · p2QUALQUER5, que é igual a um pentóxido de fósforo tri-hidratado.
O tetraedro pode até vincular covalentemente, mas para esta uma de suas unidades deve eliminar uma molécula de água através da desidratação. Isso ocorre quando H3Po4 Ele passa por aquecimento e gera como conseqüência a formação de ácidos polifosféricos (PA).
Ácido diposfórico (H4P2QUALQUER7)
O mais simples de todo o PA é o ácido diposfórico (H4P2QUALQUER7), também conhecido como ácido pirofosfórico. A equação química de sua formação é a seguinte:
Pode servir a você: fosfato de alumínio (alpo4): estrutura, propriedades, obtenção, usos2h3Po4 H4P2QUALQUER7 + H2QUALQUER
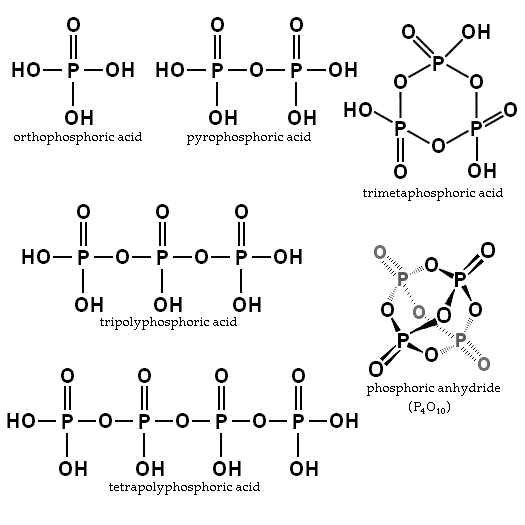
O equilíbrio depende da quantidade de água e temperatura. Qual é a sua estrutura? Na imagem da seção, as estruturas do ácido ortofosfáhico e pirofosfórico são ilustradas no canto superior esquerdo.
Duas unidades se juntam covalentemente quando uma molécula de água é eliminada, formando uma ponte de oxigênio P-O-P entre eles. Agora eles não são três hidrogênio ácido, mas quatro (quatro grupos -oh). Por causa disso, h4P2QUALQUER7 apresenta quatro constantes Kpara.
Ácidos polifosfóricos
A desidratação pode continuar com o ácido pirofosfórico se o aquecimento continuar. Porque? Porque em cada extremidade de sua molécula, há um grupo OH que pode ser eliminado como uma molécula de água, promovendo o crescimento subsequente do esqueleto P-O-O-O-P ... P ..
Exemplos desses ácidos são ácidos trimfosfóricos e tetropolifóricos (ambos também ilustrados na imagem anterior). Pode-se ver como o esqueleto P-O-P se prolonga em uma espécie de cadeia formada por tetraedra.
Esses compostos podem ser representados com a fórmula HO (PO2OH)xH, onde Ho é a extremidade esquerda que pode desidratar. Po2OH é o esqueleto de fósforo com os links p = O e OH; E x são as unidades de ácido fosfórico ou moléculas necessárias para obter a referida corrente.
Quando esses compostos são completamente neutralizados, os polifosfatos de forma assim são originários. Dependendo de quais cátions estão cercados, eles formam uma grande variedade de sais de polifosfato.
Por outro-. Assim, os ésteres de fosfato (ou polifísia) surgem: ro (PO2Ou)xR. É suficiente para substituir o H por R todas as estruturas da imagem da seção para obtê -las.
Ácidos polifosfóricos cíclicos
As cadeias P-O-P podem até ser fechadas em um anel ou ciclo fosfórico. O mais simples desse tipo de composto é o ácido trimethofosfórico (o canto superior direito da imagem). Assim, o PAS pode ser linear, cíclico; ou se suas estruturas exibirem os dois tipos, ramificados.
Nomenclatura
 Ácido fosfórico. Fonte: Commons.Wikimedia.org
Ácido fosfórico. Fonte: Commons.Wikimedia.org A nomenclatura do ácido fosfórico é governada por IUPAC e como os sais de nullion dos oxoácidos são nomeados.
Porque em h3Po4 O átomo de P tem Valência +5, aquele com o maior valor, seu ácido é atribuído o sufixo -ico ao prefixo de fósforo-.
Ortho-
No entanto, o ácido fosfórico também é comumente informado. Porque? Porque a palavra 'orto' é grego e significa 'verdadeiro'; o que resultaria na "forma verdadeira" ou "mais hidratada" do mesmo.
Quando o anidro fosfórico é hidratado com um excesso de água (p4QUALQUER10, A "imagem superior" Cap ")3Po4 (3h2Ou · p2QUALQUER5). Assim, o prefixo Ortho é concedido aos ácidos formados com água abundante.
Piro-
O prefixo PIRO refere-se a todos os compostos originados após a aplicação do calor, uma vez que o ácido diposfórico surge da desidratação térmica do ácido fosfórico. Portanto, é chamado de ácido pirofosfórico (2h2Ou · p2QUALQUER5).
Meta-
O prefixo alvo, que também é uma palavra grega, significa 'depois'. É adicionado às substâncias cuja fórmula eliminou uma molécula, neste caso, a da água:
H3Po4 => HPO3 + H2QUALQUER
Observe que desta vez a adição de duas unidades fosfóricas não ocorre para formar o ácido diposfórico, mas em vez do ácido metafosfórico é obtido (da qual não há evidência de sua existência).
Pode servir a você: álcool etílico: estrutura, propriedades, usos, obtençãoTambém é importante destacar que esse ácido pode ser descrito como H2Ou · p2QUALQUER5 (Semelhante ao hemidrato, multiplicando o HPO3 Para 2). O meta-prefixo é perfeitamente de acordo com o PAS cíclico, pois se o ácido trfosfórico ficar desidratado, mas não adiciona outra unidade H3Po4 Para se tornar ácido tetrafosfórico, então você deve formar um anel.
E isso é o mesmo com outros ácidos polimetofosfóricos, embora o IUPAC recomenda chamá -los como compostos cíclicos do PAS correspondente.
Propriedades do ácido fosfórico
Fórmula molecular
H3Po4
Peso molecular
97.994 g/mol
Aspecto físico
Em sua forma sólida, apresenta cristais ortorrômbicos, higroscópicos e transparentes. Na forma líquida, é cristalino, com uma aparência viscosa de xarope.
Comercialmente é alcançado em solução aquosa com uma concentração de 85% p/p. Em todas essas apresentações, não tem cheiro.
Pontos de ebulição e de fusão
158º C (316º F a 760 mmHg).
108º F (42,2º C).
Solubilidade em água
548 g/100 g de H2Ou 20º C; 369,4 g/100 ml a 0,5º C; 446 g/100m a 14,95º C.
Densidade
1.892 g/cm3 (sólido); 1.841 g/cm3 (Solução 100%); 1.685 g/cm3 (Solução de 85%); 1.334 g/cm3 Solução de 50%) a 25ºC.
Densidade de vapor
Air relativo 3.4 (ar = 1).
Auto -ignição
Não é inflamável.
Gosma
3,86 mPoise (40% a 20º C).
Acidez
Ph: 1,5 (solução de 0,1 N na água)
Pka: pka1 = 2.148; pka2 = 7.198 e pka3 = 12.319. Portanto, seu hidrogênio mais ácido é o primeiro.
Decomposição
Quando ele é aquecido, ele libera óxidos de fósforo. Se a temperatura subir para 213º C ou mais, ele se tornará ácido pirofosfórico (h4P2QUALQUER7).
Corrosividade
Corrosivo para metais ferrosos e alumínio. Ao reagir com esses metais, o gás combustível de hidrogênio se origina.
Polimerização
Violentemente polimeriza com compostos de farsa, epóxidos e compostos polimerizáveis.
Utiliza o ácido fosfórico
Fosfat e General usa vendas
-O ácido fosfórico serve como base para a elaboração de fosfato, que são usados como fertilizantes porque o fósforo é um nutriente principal das plantas.
-Foi usado no tratamento de envenenamento líder e outras condições nas quais são necessárias quantidades importantes de fosfato e a produção de acidose leve são necessárias.
-É usado para controlar o pH do trato urinário de vison e gatos, a fim de evitar a formação de cálculos renais.
-O ácido fosfórico causa sais de Na2HPO4 e nah2Po4 que constituem um sistema de amortecedor de pH com um PKA de 6,8. Este sistema regulador de pH está presente em humanos, tendo importância na regulação do pH intracelular, bem como no manejo da concentração de hidrogênio nos túbulos distais e coletores dos néfrons.
-É usado na eliminação da camada mohosa de óxido de ferro que se acumula neste metal. O ácido fosfórico forma fosfato de ferro, que pode ser facilmente removido da superfície do metal. Também é usado em polimento elétrico de alumínio.
Industriais
-O ácido fosfórico é destinado como um agente catalítico na elaboração de nylon e gasolina. É usado como agente desidratante na gravação litográfica, na elaboração de corantes para uso na indústria têxtil, no processo de coagulação do látex na indústria da costa e na purificação do peróxido de hidrogênio (peróxido de hidrogênio (peróxido de hidrogênio).
-O ácido é usado como um aditivo em refrigerantes que contribuem dessa maneira para o seu sabor. Diluído, é aplicado no processo de refino de açúcar. Também atua como um sistema de amortecedor na preparação de presunto, gelatina e antibióticos.
Pode atendê -lo: hidróxido de alumínio: estrutura, propriedades, usos, riscos-Intervém na elaboração de detergentes, na catálise ácida da produção de acetileno.
-É usado como um acidulante em alimentos equilibrados para a indústria de gado e animais de estimação. A indústria farmacêutica o usa na fabricação de medicamentos antieméticos. Também aproveita uma mistura para fazer asfalto para pavimentar o chão e reparar rachaduras.
-O ácido fosfórico atua como um catalisador na reação de hidratação dos alcenos para produzir álcool, principalmente etanol. Além disso, é usado na determinação do carvão orgânico em solos.
Dental
É usado pelos dentistas para limpar e condicionar a superfície dentária antes da colocação de suportes dentários. Ele também encontra uso em clareamento dental e a eliminação de placas dentárias. Além disso, é usado na fabricação de cola para próteses dentárias.
Cosméticos
O ácido fosfórico é usado para ajustar o pH na elaboração de produtos cosméticos e para cuidados com a pele. É usado como um agente de oxidação química para a produção de carbono ativado.
Formação de ácido fosfórico
-O ácido fosfórico é preparado a partir de rochas de fosfato do tipo apatita, por meio de sua digestão concentrada no ácido sulfúrico:
AC3(Po4)2 + 3 h2SW4 + 6 h2O => 2 h3Po4 + 3 (caso4.2h2QUALQUER)
O ácido fosfórico obtido nesta reação é de baixa pureza, por isso passa por um processo de purificação que inclua precipitação, extração de solvente, técnicas de cristalização e troca iônica.
-O ácido fosfórico pode ocorrer dissolvendo o pentóxido de fósforo em água fervente.
-Também pode ser obtido por aquecimento de fósforo com uma mistura de vapor de ar e água:
P4 (L) +5 O2 (g) => p4QUALQUER10 (S)
P4QUALQUER10 (s) +h2Ou (g) => 4h3Po4 (EU)
Riscos
-Como sua pressão de vapor está baixa à temperatura ambiente, é improvável que seus vapores possam ser inalados, a menos que o ácido seja pulverizado. Nesse caso, os sintomas de sua inalação incluem: tosse, dor de garganta, respiração curta e trabalhosa.
-Na literatura, o caso de um marinheiro que foi exposto a vapores de ácido fosfórico por um longo período de tempo é citado. Sofreu fraqueza geral, tosse seca, dor no peito e problemas respiratórios. Depois de um ano após a exposição, foi observada uma disfunção reativa do trato respiratório.
-O contato cutâneo com o ácido fosfórico pode causar vermelhidão, dor, bolhas e queimaduras na pele.
-O contato do ácido com os olhos, dependendo da concentração e da duração do contato, pode produzir neles, lesões corrosivas de tecido ou queimaduras graves com danos oculares permanentes.
-A ingestão de ácido faz queimar na boca e na garganta, a sensação de ardor além do esterno, dor abdominal, vômito, choque e colapso.
Referências
- Sociedade Real de Química. (2015). Ácido fosfórico. Retirado de: Chemspider.com
- Centro Canadense de Saúde e Segurança Ocupacional. (1999). Ácido fosfórico - efeitos da saúde. Retirado de: CCSSO.AC
- Ácidos.Informações. (2018). Ácido fosfórico "variedade de usos deste composto químico. Retirado de: ácidos.Informações
- James p. Smith, Walter E. Brown e James R. Lehr. (1955). Estrutura do ácido fosfórico cristalino. J. SOU. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Ácidos fosfóricos e fosfatos. Retirado de: em.Wikipedia.org
- A ciência é divertida. Aprenda sobre ácido fosfórico. [PDF]. Retirado de: Scifun.Chem.WISC.Edu

