Características da catalase, estrutura, funções, patologias
- 1784
- 141
- Shawn Leffler
O Catalase É uma enzima oxidoredutase (H2O2: H2O2 oxidorreredutase) amplamente distribuída na natureza. Catalisa, em vários tecidos e tipos de células, a reação de "decomposição" do peróxido de hidrogênio no oxigênio molecular e na água.
As primeiras observações desse tipo de enzima datam do início da década de 1810, mas foi em 1901 quando Loew reconheceu que a catalase está praticamente presente em todos os organismos vivos existentes e em vários tipos de células diferentes.
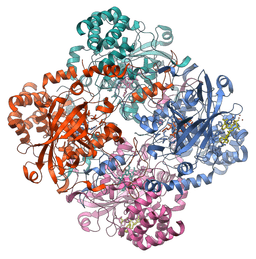
 Estrutura molecular da enzima catalase (fonte: Vossman [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Estrutura molecular da enzima catalase (fonte: Vossman [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Essa enzima, crucial para a manutenção da integridade celular e o principal regulador do metabolismo do peróxido de hidrogênio, foi um fator fundamental para afirmar que, na natureza, existem enzimas que agem em substratos específicos.
Mamíferos e outros organismos têm enzimas catalas que também podem se comportar como peroxidases, catalisando reações oxidantes de diferentes substratos usando peróxido de hidrogênio.
Na maioria dos eucariotos, as enzimas das catalas são prepondeentemente em organelas subcelulares conhecidas como "peroxissomos" e, em humanos, existem numerosas condições patológicas relacionadas à deficiência dessa enzima.
[TOC]
Caracteristicas
A atividade de enzimas como a catalase pode variar consideravelmente, dependendo do tipo de tecido considerado. Nos mamíferos, por exemplo, a atividade da catalase é significativa tanto nos rins quanto no fígado, e é muito menor em tecidos conjuntivos.
Para que a catalase em mamíferos esteja principalmente associada a todos os tecidos que possuem metabolismo aeróbico significativo.
Os mamíferos têm catalas tanto nas mitocôndrias quanto em peroxissomos e em ambos os compartimentos são enzimas associadas a membranas organelárias. Nos eritrócitos, pelo contrário, a atividade da catalase está associada a uma enzima solúvel (lembre -se de que os eritrócitos têm escassos organelas internas).
Pode atendê -lo: meio stuart: fundação, preparação e usosA catalase é uma enzima com um alto número de substituição ou catalítico constante (é muito rápido e eficiente) e a reação geral que os catalisam é a seguinte:
2H2O2 → 2H2O + O2
Na presença de baixas concentrações de peróxido de hidrogênio, a catalase de mamíferos, por exemplo, se comporta como uma oxidase, usando oxigênio molecular (O2) para oxidar moléculas como indol e β-peniletilamina, precursores do aminoácido triptofano e neurotransmissores, respectivamente, respectivamente.
Alguns inibidores competitivos da atividade da catalase são atualmente conhecidos e entre eles se destacam o sódio e o 3-aminotriazol azid. Azida, em sua forma aniônica, é um poderoso inibidor de outras proteínas com grupos Hemo e é usado para a eliminação ou prevenção do crescimento do microorganismo em diferentes condições.
Estrutura
Nos seres humanos, a catalase é codificada por um gene de 34 kb que possui 12 íntrons e 13 exons e codificações para uma proteína de 526 aminoácidos.
A maioria das catalas estudadas são enzimas tetraméricas com um peso molecular próximo a 240 kDa (60 kDa para cada subunidade) e cada monômero está associado a um grupo protético de hemina ou ferroproporfirina.
Sua estrutura é composta por quatro domínios compostos por estruturas secundárias formadas por Alfa Hellices e folhas agregadas β, e estudos realizados na enzima do fígado de humanos e gado mostraram que essas proteínas estão ligadas a quatro moléculas NADPH.
Essas moléculas de NADPH não parecem essenciais para a atividade enzimática da catalase (para a produção de água e oxigênio a partir de peróxido de hidrogênio), mas parece relacionar -se a uma diminuição na suscetibilidade dessa enzima em comparação com as altas concentrações de seu substrato tóxico.
Os domínios de cada subunidade na catalase dos humanos são:
Pode atendê -lo: carotenóides-Um braço N-terminal não globular estendido, que funciona para a estabilização da estrutura quaternária
-Um barril β de oito antiparalleos de β-dobras, que fornecem alguns dos resíduos de junção lateral para o grupo Hemo
-Um domínio de "embrulho" que envolve o domínio externo, incluindo o grupo Hemo e, finalmente
-Um domínio com estrutura de hélice alfa
As quatro subunidades, com esses quatro domínios, são responsáveis pela formação de um canal longo cujo tamanho é crítico para o mecanismo de reconhecimento do peróxido de hidrogênio pela enzima (que usa aminoácidos como histidina, asparagina, glutamina e ácido aspártico para ele ).
Funções
Segundo alguns autores, a catalase cumpre duas funções enzimáticas:
-Decomposição de peróxido de hidrogênio em água molecular e oxigênio (como uma peroxidase específica).
-A oxidação de doadores de prótons, como metanol, etanol, muitos fenóis e ácidos fórmicos, usando uma toupeira de peróxido de hidrogênio (como uma peroxidase inespecífica).
-Nos eritrócitos, a grande quantidade de catalase parece desempenhar um papel importante na proteção da hemoglobina em frente a agentes oxidantes, como peróxido de hidrogênio, ácido ascórbico, metil -hidrazina e outros.
A enzima presente nessas células é responsável pela defesa de outros tecidos com pouca atividade catalase em comparação com altas concentrações de peróxido de hidrogênio.
-Alguns insetos como a catalase de uso do besouro bombardeiro como mecanismo de defesa, à medida que o peróxido de hidrogênio se decompõe e usa o produto gasoso de oxigênio da referida reação para impulsionar a produção de água e outros compostos químicos na forma de.
-Nas plantas, a catalase (também presente em peroxissomos) é um dos componentes do mecanismo de fotorerspiração, durante o qual o fosfoglicato produzido pela enzima Rubisco é usado para a produção de 3-fosfoglicerados.
Pode atendê -lo: ciclo LoosPatologias relacionadas em humanos
As principais fontes de produção do substrato catalase, peróxido de hidrogênio, são as reações catalisadas por enzimas oxidase, espécies reativas de oxigênio e algumas células tumorais.
Este composto está envolvido nos processos inflamatórios, na expressão de moléculas adesivas, na apoptose, na regulação da agregação de plaquetas e no controle da proliferação celular.
Quando há deficiências dessa enzima, são geradas altas concentrações de seu substrato, o que produz lesões na membrana celular, defeitos no transporte eletrônico em mitocôndrias, no metabolismo da homocisteína e no DNA.
Entre as doenças associadas a mutações no gene da codificação para a catalase dos seres humanos, podem ser mencionados:
-Diabetes mellitus
-Hipertensão arterial
-Alzheimer
-Vitiligo e outros
Referências
- Agar, n., Sadrzadeh, s., FinDo, p., & Eaton, J. (1986). Catalase de eritrócitos. Uma defesa somática oxidante? J. Clin. Investir., 77, 319-321.
- Góth, l., Rass, p., & Pagar para. (2004). Mutações enzimáticas catalase e sua associação com projetos. Diagnóstico molecular, 8(3), 141-149.
- Kirkman, h., & Gaetanit, g. F. (1984). Catalase: uma enzima tetramérica com quatro moléculas fortemente ligadas de NADPH. Proc. Natl. Acade. Sci. Usos, 81, 4343-4347.
- Kirkman, h. N., & Gaetani, g. F. (2006). Catalase de mamíferos: venerável enzima com novos mistérios. Tendências em ciências bioquímicas, 32(1), 44-50.
- Rawn, j. D. (1998). Bioquímica. Burlington, Massachusetts: Neil Patterson Publishers.
- Salomão, e., Berg, l., & Martin, D. (1999). Biologia (5ª ed.). Filadélfia, Pensilvânia: Saunders College Publishing.
- Vinshtein, b., Melik-Adamyan, w., Baringynin, v., Vagin, a., & Grebenko, um. (1981). Estrutura tridimensional da enzima catalase. Natureza, 293(1), 411-412.
- « Características de Lacasas, estrutura, funções
- Características de movimento retilíneo uniformemente acelerado, fórmulas, fórmulas »

