Estrutura de carbonato de alumínio, propriedades, usa
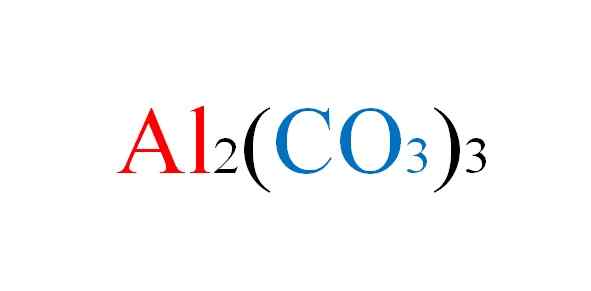
- 3986
- 983
- Ernesto Bruen
Ele Carbonato de alumínio É um sal inorgânico cuja fórmula química é o2(Co3)3. É um carbonato metálico praticamente não existente, dada sua alta instabilidade em condições normais.
Entre as razões de sua instabilidade, podemos mencionar as interações eletrostáticas fracas entre os íons para o3+ e companhia32-, que em teoria deve ser muito forte para as magnitudes de suas cargas.
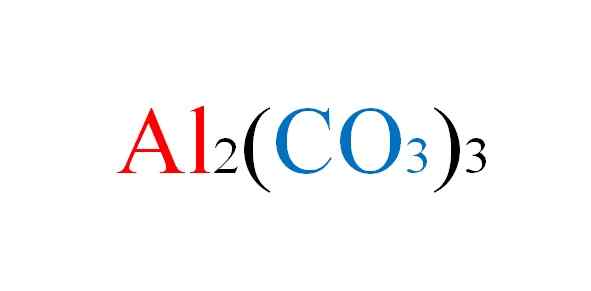 Fórmula de carbonato de alumínio. Fonte: Gabriel Bolívar.
Fórmula de carbonato de alumínio. Fonte: Gabriel Bolívar. O sal enfrenta qualquer inconveniente no papel quando as equações químicas de suas reações são escritas; Mas na prática é contra isso.
Apesar do que foi dito, o carbonato de alumínio pode ocorrer na companhia de outros íons, como é o caso do mineral Dawsonita. Há também um derivado em que interage com a amônia aquosa. Do resto, é considerado uma mistura entre Al (OH)3 e h2Co3; que é igual a uma solução efervescente com um precipitado branco.
Esta mistura tem usos medicinais. No entanto, para o sal puro, isolável e manipulável de Al2(Co3)3, Você não é conhecido possíveis aplicativos; Pelo menos não baixas grandes pressões ou condições extremas.
[TOC]
Estrutura de carbonato de alumínio
A estrutura cristalina para este sal é desconhecida, porque é tão instável que não foi capaz de ser caracterizado. De sua fórmula para2(Co3)3, No entanto, sabe -se que a proporção de íons para o3+ e companhia32- É 2: 3; ou seja, para dizer isso para cada dois cátions para o2+ Deve haver três ânions co32- interagindo eletroestaticamente com eles.
O problema é que ambos os íons são muito desiguais em relação aos seus tamanhos; Al3+ É muito pequeno enquanto o CO32- É volumoso. Essa diferença, por si só, já afeta a estabilidade reticular da rede cristalina, cujos íons interagiriam "desajeitadamente" se esse sal em estado sólido for isolado.
Pode atendê -lo: Avogadro Número: História, Unidades, como é calculado, usaAlém desse aspecto, Al3+ É um cátion altamente polarizador, propriedade que deforma a nuvem eletrônica do CO32-. É como se ele quisesse forçá -lo a se vincular covalentemente, mesmo que o ânion não possa fazê -lo.
Consequentemente, interações iônicas entre Al3+ e companhia32- Eles tendem à covalência; Outro fator que aumenta a instabilidade de Al2(Co3)3.
Amônio de alumínio carbonato de hidróxido
A relação caótica entre Al3+ e companhia32- Ele amolece a aparência quando há outros íons presentes no vidro; como NH4+ e oh-, De uma solução de amônia. Este quarteto de íons, para o3+, Co32-, NH4+ e oh-, Eles conseguem definir cristais estáveis, até capaz de adotar diferentes morfologias.
Outro exemplo semelhante a isso é observado no mineral Dawsonita e em seus cristais ortorrômbicos, Naalco3(OH)2, Onde o na+ Substitua NH4+. Nestes sais, seus títulos iônicos são fortes o suficiente para que a água não promova a liberação de CO2; Ou pelo menos não abruptamente.
Embora o NH4Al (oh)2Co3 (AACC, por seus sigles em inglês), nem o Naalco3(OH)2 Eles representam carbonato de alumínio, podem ser considerados como derivados básicos do mesmo.
Propriedades
Massa molar
233,98 g/mol.
Instabilidade
Na seção anterior, foi explicado de uma perspectiva molecular por que Al2(Co3)3 É instável. Mas que transformação sofre? Você tem que considerar duas situações: uma seca e outra "molhada".
Seco
Na situação seca, o Anion Co32- CO é revertido2 Através da seguinte decomposição:
Para o2(Co3)3 => Al2QUALQUER3 + 3CO2
Pode servir a você: fosfato de cálcio (CA3 (PO4) 2)O que faz sentido se for sintetizado sob alumina a grandes pressões de CO2; isto é, a reação reversa:
Para o2QUALQUER3 + 3CO2 => Al2(Co3)3
Portanto, para evitar decompor o Al2(Co3)3 Você teria que enviar sal para grandes pressões (usando n2, por exemplo). Dessa forma, a formação de CO2 não seria preferido termodinamicamente.
Molhado
Enquanto estava na situação úmida, o CO32- Sofra hidrólise, que gera pequenas quantidades de OH-; Mas o suficiente para o hidróxido de alumínio precipitar, em (oh)3:
Co32- + H2Ou HCO3- + Oh-
Para o3+ + 3oh- Al (oh)3
E por outro lado, o Al3+ Também é hidrolisado:
Para o3+ + H2Ou (oh)22+ + H+
Embora fosse realmente hidratado3+ Para formar o complexo para (h2QUALQUER)63+, que é hidrolisado para dar [h2QUALQUER)5Oh]2+ e h3QUALQUER+. Então, h3Ou (ou h+) Protona para CO32- para h2Co3, que se decompõe para co2 e h2QUALQUER:
Co32- + 2h+ => H2Co3
H2Co3 Co2 + H2QUALQUER
Observe que no final o Al3+ Ele se comporta como um ácido (liberação h+) e uma base (libere oh- Com o equilíbrio de solubilidade de Al (OH)3); isto é, exibe anfoterismo.
Físico
Para poder se isolar, é provável que esse sal seja branco, como muitos outros sais de alumínio. Além disso, devido à diferença entre os rádios iônicos de Al3+ e companhia32-, Certamente teria pontos de fusão ou ebulição muito baixos em comparação com outros compostos iônicos.
Pode atendê -lo: Benchilo: hidrogênios benzil, carbocações, radicais benzilE em relação à sua solubilidade, seria infinitamente solúvel em água. Além disso, seria um sólido higroscópico e delicioso. No entanto, essas são apenas conjecturas. Outras propriedades teriam que ser estimadas com modelos de cálculos sujeitos a altas pressões.
Formulários
As aplicações conhecidas em carbonato de alumínio são médicas. Foi usado como adstringente suave e como uma droga para tratar a inflamação e úlcera gástrica. Também tem sido usado para impedir a formação de cálculos urinários em humanos.
Foi usado para controlar um aumento no conteúdo corporal de fosfato e também para tratar os sintomas de acidez do estômago, indigestão ácida e úlceras estomacais.
Referências
- Xuehui l., Zhe t., Yongming c., Ruiyu z. & Chenguang l. (2012). Síntese hidrotérmica do hidróxido de carbonato de alumínio amônio (AACH) nanoplatelas e nanofibras morfologias controladas por pH. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Hidróxido de alumínio de amônio NH4AL (OH) 2CO3 como uma rota alternativa para preparação de alumínio: comparação com o clássico Boehmite precursor. Powder Technology, 320, 565-573, doi: 10.1016/j.Powec.2017.07.0080
- Centro Nacional de Informações sobre Biotecnologia. (2019). Carbonato de alumínio. Banco de dados PubChem., CID = 1035396. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- Wikipedia. (2019). Carbonato de alumínio. Recuperado de: em.Wikipedia.org
- Alumumumsulfate. (2019). Carbonato de alumínio. Recuperado de: aluminumsulfate.líquido

