Formação de carbocação, características, tipos, estabilidade
- 3325
- 229
- Mr. Reginald Lindgren
A Carbocation, Como o nome indica, é um íon orgânico que possui um átomo de carbono carregado positivamente, que é caracterizado por ser altamente instável, existente por um curto período de tempo. Geralmente é um intermediário em reações orgânicas, ou seja, se origina como etapas indispensáveis dos respectivos mecanismos moleculares.
Historicamente, houve pontos de conflito na compressão do que é o carbocalização. Isso ocorre porque existem sinfinas de moléculas reativas que, por algum motivo ou outro, adquirem uma carga positiva em um de seus carbonos. Carbocalização clássica, por assim dizer, é aquela que pode ser representada pela fórmula geral da imagem abaixo.
 Fórmula geral de um carbocalização. Fonte: Gabriel Bolívar.
Fórmula geral de um carbocalização. Fonte: Gabriel Bolívar. Observe como a carga positiva está localizada exatamente no átomo de carbono e também não tem um link. Portanto, o carbocalização é de elétrons ruins, sendo essa a causa de sua alta reatividade.
Suponha que metano, CHO4. Se o carbono perdesse um de seus átomos de hidrogênio, estaríamos eliminando uma das quatro ligações C-H. Então o carbocalização de metila originou, CH3+, que poderíamos representar apenas colocando os átomos de hidrogênio nas extremidades das faixas da fórmula superior. O ch3+ É o mais simples de todas as carbocações.
[TOC]
Treinamento
Como as carbocações são formadas? A resposta é encontrada nos mecanismos de reações. No entanto, a grande participação da maioria em comum um dos dois aspectos a seguir:
-Ruptura heterolítica
-Adição de elétrons π a um eletrofilo
Ruptura heterolítica
Na ruptura heterolítica da ligação C-G, sendo G qualquer átomo ou grupo, é quebrado de maneira desigual: os elétrons da ligação são deixados G, enquanto o átomo de carbono adquire uma carga positiva. Por exemplo:
Pode atendê -lo: arsênico: história, estrutura, propriedades, usos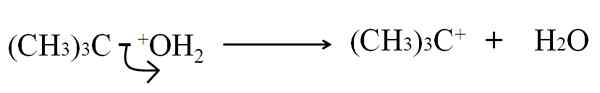 Ruptura heterolítica na desidratação de tercutanol. Fonte: Gabriel Bolívar.
Ruptura heterolítica na desidratação de tercutanol. Fonte: Gabriel Bolívar. Agora, essa ruptura pode ser dada para vários métodos, que por sua vez mudarão o mecanismo e a reação considerados.
Adição de elétrons π a um eletrofilo
O outro processo pelo qual um carbocação é formado, sendo muito comum em alcenos e compostos aromáticos, é atacando elétrons de uma ligação dupla a um eletrofilo. Os casos mais comuns são a hidrogenação dos alcenos pela ação de um ácido:
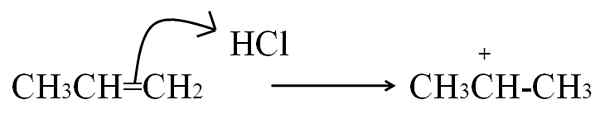 Reação de HCl com o Prono para formar um carbocalização como intermediário. Fonte: Gabriel Bolívar.
Reação de HCl com o Prono para formar um carbocalização como intermediário. Fonte: Gabriel Bolívar. Esta equação corresponde à formação de carbocalização, que é um intermediário, Não é um produto. Os elétrons de ligação dupla atacam hidrogênio HCl, o eletrofilo. O hidrogênio é adicionado ao carbono à direita da ligação dupla, de modo que o grupo -Ch é formado3, Enquanto o carbono à esquerda adquire a carga positiva.
Caracteristicas
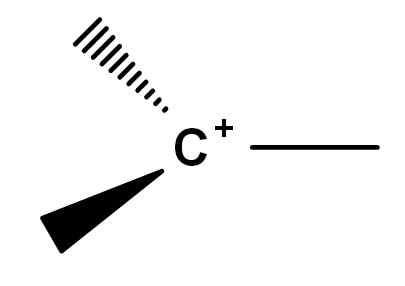
Hibridação
A fórmula geral apresentada no início revela uma geometria plana trigonal em torno do átomo de carbono. Isso se deve à hibridação sofrida por orbitais atômicos de carbono para se tornarem orbitais híbridos de SP2, que são separados em um ângulo de 120º. Embora não esteja representado, o carbocalização tem um orbital p Puro e vazio, capaz de aceitar elétrons.
Acidez
Carbocation é uma espécie ácida, de acordo com a definição de Brönsted ou Lewis. Seus elétrons de demanda positiva de carga ou átomos de hidrogênio que são dados. É por esse motivo que as carbocações não podem ser formadas em mídia muito básica, pois eles reagiriam imediatamente a originar outros produtos.
Estabilidade
A hibridação sp2 de carbocação torna vulnerável a ataques de espécies ricas em elétrons. Este recurso é ainda mais acentuado por sua grande acidez. Consequentemente, a carbocação é uma espécie muito reativa, que dificilmente é formada e em breve (em uma questão de nanossegundos) reage para dar origem ao verdadeiro produto da reação química.
Pode atendê -lo: ácido sulfâmico: estrutura, propriedades, síntese, usosTipos de carboca
Existem vários tipos de carbocações. No entanto, eles podem ser classificados da seguinte maneira:
-Primário
-Secundário
-Terciário
-Aromático ou arilos
-Vinil e alílico
Primário
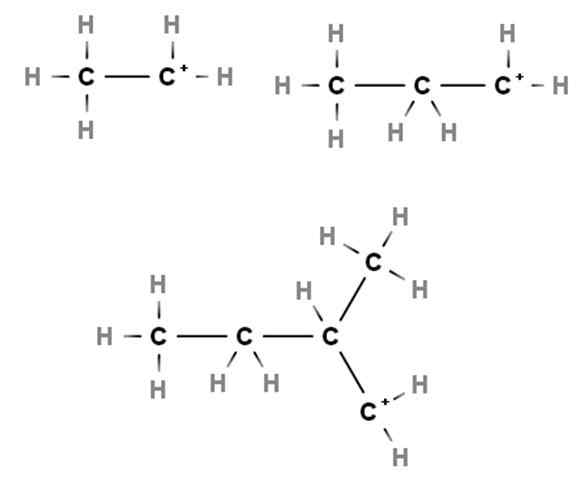 Carbocações primárias. Fonte: Gabriel Bolívar via Molview.
Carbocações primárias. Fonte: Gabriel Bolívar via Molview. As chegadas mostram exemplos de carboca -primas. Eles são chamados assim porque a carga positiva está em um carbono primário, 1º, por isso só está ligado a um átomo de carbono. Etano, cap3CH3, Quando um h perde qualquer um de seus fins, carbocalocatia3CH2+ qualquer +CH2CH3.
Secundário
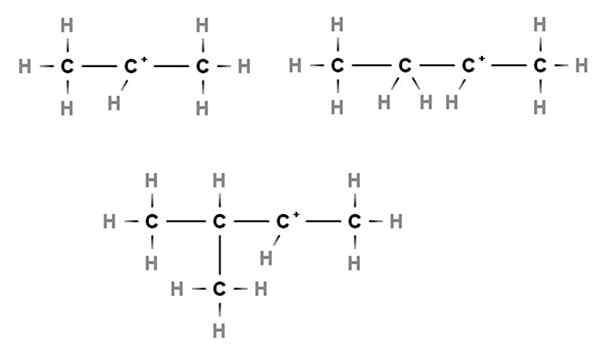 Carbocações secundárias. Fonte: Gabriel Bolívar via Molview.
Carbocações secundárias. Fonte: Gabriel Bolívar via Molview. Em carbocações secundárias, a carga positiva está localizada em um carbono secundário, 2º, que está ligado a dois átomos de carbono. Por exemplo, se o propano, Cho3CH2CH3, Tomamos um h do carbono central, teremos o carbocation Cho3CH2+CH3.
Terciário
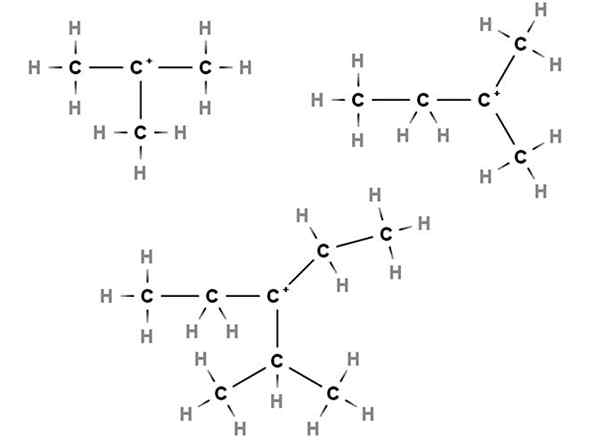 Carbocações terciárias. Fonte: Gabriel Bolívar via Molview.
Carbocações terciárias. Fonte: Gabriel Bolívar via Molview. Em carbocações terciárias, a carga positiva está localizada em um carbono terciário, 3º, ligado a três átomos de carbono. Observe que, diferentemente dos dois primeiros tipos de carboca, eles não têm átomos de hidrogênio.
Assim, temos metilpropano ou isobutano, CH (CH (Escolha3)3, Que, perdendo um hidrogênio, o carbono central forma carbocação +C (cap3)3.
Aromático
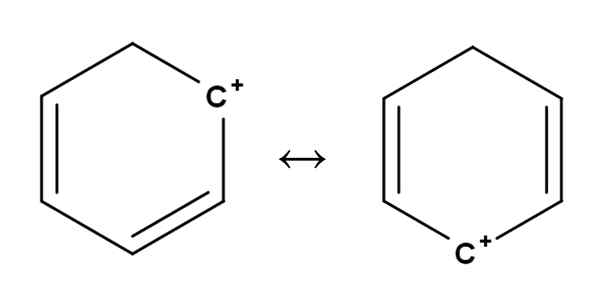 Benzeno Carbocat. Fonte: Gabriel Bolívar.
Benzeno Carbocat. Fonte: Gabriel Bolívar. Carbocações aromáticas ou aromáticas são talvez as mais especiais de todas. Seu treinamento é muito semelhante ao descrito para alcenos na primeira seção.
Neles, a carga positiva está localizada, em princípio, em um dos carbonos de um anel aromático, como o benzeno. No entanto, a carga positiva não é fixa, mas é dispersa em outras posições do anel por ressonância.
Pode atendê-lo: ribulosa-1,5-bifosfato (rubp): características, carbolixaçãoÉ assim que a carga positiva, como visto acima, passa de um carbono para outro dentro do anel benzeno. Essa característica dá a este carbocalização grande estabilidade contra os outros tipos de carbocações.
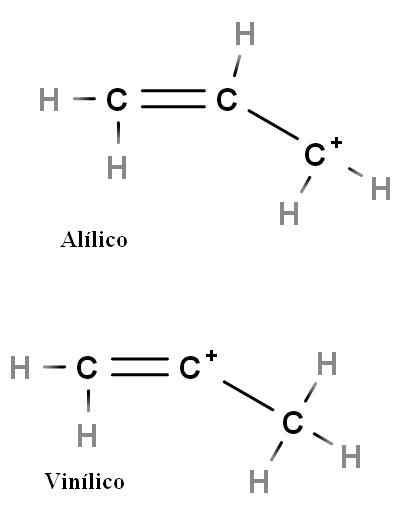
Alílico e vinil
 Carbocalização de alílicos e vinil. Fonte: Gabriel Bolívar.
Carbocalização de alílicos e vinil. Fonte: Gabriel Bolívar. Outros tipos especiais de carboca são alilic e vinil. A diferença entre eles (acima) é a posição da carga positiva relacionada à ligação dupla.
Na carbocação de vinil, a carga positiva é encontrada em um dos carbonos de ligação dupla; Enquanto estiver em carbocação allyic, a carga positiva está localizada no carbono após a ligação dupla. É o suficiente para substituir hidrogênios por outros grupos e teremos uma enorme família de carboca -allyic e vinil.
Estabilidade relativa
Sabendo quais são os principais tipos de carboca, eles podem ser ordenados com base em sua relativa estabilidade:
Vinil < Primario < Secundario < Alílico < Terciario < Aromático
Agora, pode haver carbocações alic que são mais estáveis do que um terciário específico. Tudo vai depender de seus substituintes.
Por que essa estabilidade? À capacidade da molécula de dispersar ou reduzir a carga positiva de carbocação. Para fazer isso, você precisa de átomos próximos que dêem parte de sua densidade eletrônica de carbocalização por hiperconjugação. Enquanto isso, em carbocações alumics e aromáticas, isso é alcançado pela ressonância.
No caso de carbocalização de vinil, a carga positiva está localizada em um carbono que já era SP2, O que o torna muito instável.
Referências
- Graham Solomons t.C., Craig b. Fryhle. (2011). Química orgânica. (10º Edição.). Wiley Plus.
- Carey f. (2008). Quimica Organica. (Sexta edição). Mc Graw Hill.
- Morrison e Boyd. (1987). Quimica Organica. (Quinta edição). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Carbocation. Recuperado de: em.Wikipedia.org
- James Ashenhurst. (20 de fevereiro de 2020). 3 fatores que estabilizam as carbocações. Recuperado de: MasterorganicChemistry.com
- Clark Jim. (2000). Carbocações (ou íons carbonium). Recuperado de: Chemguide.co.Reino Unido
- Dr. Kennepohl, Prof. S. Fazendeiro & T. Soderberg. (10 de agosto de 2020). Estrutura de carbocação e estabilidade. Química Librettexts. Recuperado de: química.Librettexts.org
- « Conceito, características e exemplos de códigos éticos ambientais
- As 4 estações do ano no México e suas características »

