Benzaldeído
- 1965
- 102
- Tim Mann
Explicamos o que o benzaldeído, suas propriedades físicas e químicas, estrutura química, aplicações e síntese é
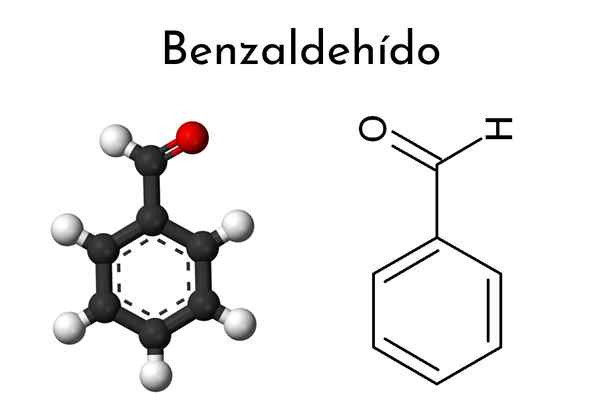
 Estrutura química do benzaldeído
Estrutura química do benzaldeído O que é benzaldeído?
Ele Benzaldeído É um composto orgânico cuja fórmula química é c6H5Cho. À temperatura ambiente, é um líquido incolor que pode se tornar amarelado com armazenamento. Representa o aldeído aromático mais simples e o mais usado industrialmente. Neste grupo de formil está ligado diretamente ao anel benzeno.
É naturalmente encontrado no córtex das hastes, folhas e sementes de plantas, como: amêndoa, cereja, pêssego e maçã. Também pode ser encontrado em óleos de amêndoa de óleo, patchulí, jacinto e cananga. O benzaldeído pode ser absorvido pela pele e pulmões, mas é rapidamente metabolizado no ácido benzóico.
Isso é combinado com ácido glucurônico ou glicina e é excretado na urina. É usado como um sabor de alguns alimentos, na indústria de perfumes e na indústria farmacêutica. Sua maior importância é que, do benzaldeído, compostos como ácido benzil, ácido cinâmico, ácido mandeliano, etc.
Os compostos previamente nomeados têm numerosos usos. Além disso, o benzaldeído é um combustível incompatível com fortes agentes oxidantes, ácidos fortes e agentes reduzidos e luz.
Benzaldeído Propriedades físicas e químicas
Nomes químicos
Benzaldeído, benzóico, benzenocarbonal, fenilmetano e benzenocarboxaldehyde aldeído.
Fórmula molecular
C7H6O o c6H5Cho
Cor
É um líquido incolor que pode se tornar amarelado.
Cheiro
Semelhante ao de amêndoa amarga.
Sabor
Aromático aromático.
Ponto de ebulição
- 354 ºF a 760 mmHg.
- 178,7 ºC.
Ponto de fusão
- 15 ºF.
- 26 ºC.
Solubilidade
- Na água, 6.950 mg/L a 25 ° C, porque é um composto predominantemente apolar e interage fracamente com moléculas de água.
- Miscível com álcool, éter, óleos fixos e voláteis.
- Solúvel em amônio líquido, solvente apolar.
Densidade
- 1.046 g/cm3 a 68 ºf.
- 1.050 g/cm3 a 15 ºC.
- Seu vapor é mais denso que o ar: 3,65 vezes em relação a isso.
Estabilidade
É estável à temperatura ambiente. No entanto, oxidado no ar em ácido benzóico.
Gosma
1.321 cp a 25 ° C
Estrutura
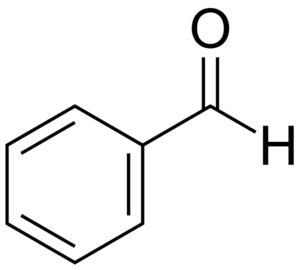
Como pode ser visto na primeira imagem, a estrutura do benzaldeído. Então, o benzaldeído é um composto orgânico, aromático e polar.
Qual é a sua geometria molecular? Como todos os átomos de carbono que compõem o anel benzeno têm hibridação SP2, bem como o do grupo formil, a molécula repousa no mesmo plano e, consequentemente, pode ser visualizado como um quadrado (ou retângulo, visto axialmente).
Interações intermoleculares
O grupo formil estabelece um momento de dipolo permanente na molécula de benzaldeído, embora notavelmente fraca em comparação com o do ácido benzóico.
Isso permite que você tenha interações intermoleculares mais fortes do que as do benzeno, cujas moléculas só podem interagir através das forças de Londres (induzido dipolo-dipol-dipmers).
O acima é refletido em suas propriedades físicas, como o ponto de ebulição, que é duas vezes superior que o de benzeno (80 ºC).
Além disso, o grupo de formil não tem a capacidade de formar pontes de hidrogênio (o hidrogênio está ligado ao carbono, não ao oxigênio). Isso torna impossível para as moléculas de benzaldeído formarem arranjos tridimensionais, como os observados em cristais de ácido benzóico.
Usa/aplicações
Agente aditivo e aromatizante e aromatizante
É um composto que serve como base para medicamentos, corantes, perfumes e na indústria de resinas. Também pode ser usado como solvente, plastificante e lubrificante para baixas temperaturas. É usado para aromatizar ou temperar comida e tabaco.
Pode servir a você: dicromato de potássio: fórmula, propriedades, riscos e usosÉ usado na preparação de sabores, como amêndoa, cereja e noz. Também é usado como um agente aromatizante em xarope de cereja enlatada. Ele intervém na elaboração de faixas de violeta, jasmim, acácia, girassol, etc., e é usado na fabricação de sabão. É usado como aditivo de combustível e combustível.
Aplicações não convencionais
Ele intervém como um reagente na determinação de ozônio, fenol, alcalóides e metileno. Atua como um intermediário da regulação do crescimento da planta.
Benzaldeído e N-heptaldeído inibem a recristalização da neve, evitando a formação de depósitos profundos de gelo, causando esmolas na neve. No entanto, esse uso é objetado porque é uma fonte de poluição ambiental.
Repelente
O benzaldeído é usado como um repelente de abelhas, usando as colmeias em conjunto com a fumaça para afastar as abelhas da colméia e poder trabalhar sem riscos, evitando as mordidas.
Na síntese da malaquita
Malaquiita verde é um composto sintetizado com a intervenção do benzaldeído. O corante é usado na agricultura de peixes para combater doenças de peixes, como o conhecido de pontos brancos e infecções por fungos.
Só pode ser usado em aquários, uma vez que efeitos nocivos nos mamíferos foram relatados, entre os quais carcinogênese, mutagênese, teratogênese e cobrança cromossômica; É por isso que seu uso foi proibido em muitos países.
Também é usado em microbiologia para a coloração de esporos bacterianos.
Intermediário sintético
- O benzaldeído é intermediário na síntese do ácido cinâmico usado nos condimentos, mas seu principal uso é na obtenção de metil, etil e ésteres de benzil usados na indústria de perfumaria. O ácido cinâmico induz citasia e reversão das propriedades malignas de células tumorais humanas humanas Em vitro.
- O benzaldeído intervém na síntese de álcool benzílico, que, embora seja usado como um solvente de tempero e industrial, sua principal função é servir como intermediário para a síntese de compostos usados na indústria farmacêutica e produção de perfumes, especiarias e alguns anilina corantes.
- O benzaldeído é um intermediário na síntese do ácido mandélico. Isso é usado no tratamento de problemas de pele, como envelhecimento devido à exposição à luz solar, pigmentação irregular e acne.
- Possui uso antibacteriano atuando como um antibiótico oral em infecções do trato urinário.
Síntese
A forma mais usada de síntese de benzaldeído é pela oxidação catalítica de Tolueno, usando catalisadores de óxido de manganês (MNO2) e óxido de cobalto (COO). Ambas as reações são realizadas com ácido sulfúrico como um meio.

