História de enxofre, propriedades, estrutura, obtenção, usa

- 4168
- 1051
- Gilbert Franecki
Ele enxofre É um elemento não -metálico que leva, abaixo do oxigênio, o grupo de calcógenos na tabela periódica. Está especificamente localizado no grupo 16 com o período 3 e é representado com o símbolo químico s. De seus isótopos naturais, o 32S está dormindo muito (cerca de 94% de todos os átomos de enxofre).
É um dos elementos mais abundantes do mundo, compondo aproximadamente 3% de sua massa total. Ou seja, se todo o enxofre do planeta fosse levado, duas luas amarelas poderiam ser construídas; haveria três satélites em vez de um. Ele pode adotar vários estados de oxidação (+2, -2, +4 e +6); portanto, seus sais são numerosos e enriquecem o córtex terrestre e o núcleo.
 Cristais de enxofre. Fonte: Pixabay.
Cristais de enxofre. Fonte: Pixabay. O enxofre é sinônimo de amarelo, cheiros maus e inferno. A principal razão de seus maus odores é devido aos seus compostos derivados; especialmente gasoso e orgânico. Do resto, seus minerais são sólidos e têm cores que incluem amarelo, cinza, preto e branco (entre outros).
É um dos elementos que a maioria apresenta um amplo número de muitos. Pode ser encontrado como moléculas pequenas e discretas de S2 ou s3; como anéis ou ciclos, sendo o enxofre ortorrômbico e monoclínico8 o mais estável e abundante de todos; E como correntes helicoidais.
Não é apenas encontrado no córtex terrestre na forma de minerais, mas também nas matrizes biológicas de nossos corpos. Por exemplo, é em cistina, cisteína e aminoácidos de metionina, em proteínas de ferro, queratina e vitaminas. Também está presente em alho, toranjas, cebola, repolho, brócolis e cauliflor.
Quimicamente é um elemento macio e, na ausência de oxigênio, forma minerais e sulfatos de sulfuro. Queimaduras com uma chama azulada e podem ser mostradas como um sólido amorfo ou cristalino.
Apesar de ser indispensável para a síntese de ácido sulfúrico, substância altamente corrosiva e premiação de odores desagradáveis, é na verdade um elemento benigno. O enxofre pode ser armazenado em qualquer espaço sem grandes precauções, desde que os incêndios sejam evitados.
[TOC]
História do enxofre
Na Bíblia
O enxofre é um dos elementos mais antigos da história da humanidade; Tanto é assim que sua descoberta é incerta e não se sabe qual das civilizações antigas o usou pela primeira vez (4000 anos antes de Cristo). Nas mesmas páginas da Bíblia, você pode encontrá -la acompanhando o fogo infernal e as avarias.
Acredita -se que o suposto cheiro do inferno tenha a ver com erupções vulcânicas. Seu primeiro descobridor certamente teve para encontrar minas desse elemento como pó de terra ou cristais amarelos nas proximidades de um vulcão.
Antiguidade
Este sólido amarelado logo demonstrou efeitos de cura notáveis. Por exemplo, os egípcios usaram enxofre para tratar as inflamações das pálpebras. Também aliviou a sarna e a acne, uma aplicação que hoje pode ser vista em sabonetes de enxofre e outros itens dermatológicos.
Os romanos usaram esse elemento em seus rituais, como fumigante e branqueamento. Quando Librara Sos2, O gás que inundou os quartos se misturando com umidade e fornecendo um meio antibacteriano e capaz de aniquilar insetos.
Os romanos, como os gregos, descobriram a alta combustibilidade do enxofre, então ficou sinônimo de fogo. A cor de suas chamas azuladas teve que iluminar os circos romanos. Acredita -se que os gregos, enquanto isso, usaram esse elemento para criar armas incendiárias.
Os chineses do seu lado aprenderam que misturar enxofre com salgadinho (KNO3) e o carvão criou a pólvora preta que pagou uma rotatividade histórica, e isso despertou nas nações de grandes demandas e juros neste mineral.
Pode servir a você: Circonium: História, Propriedades, Estrutura, Riscos, UsosTempos modernos
Como se a pólvora não fosse um motivo suficiente para cobiçar enxofre, ácido sulfúrico e aplicações industriais logo emergiram. E com a varinha de ácido sulfúrico, a quantidade de riqueza ou prosperidade de um país em relação aos níveis de consumo desse composto foi medida.
Não foi até 1789 quando o brilhante químico Antoine Lavoisier conseguiu reconhecer o enxofre e classificá -lo como um elemento. Então, em 1823, o químico alemão Eilhard Mitcherlich descobriu que o enxofre pode se cristalizar predominantemente de duas maneiras: rhomboédrica e monoclinic.
A história do enxofre seguiu o mesmo canal de seus compostos e aplicações. Com a enorme importância industrial do ácido sulfúrico, ele acompanhou a vulcanização de borrachas, a síntese de penicilina, exploração de mineração, refino de petróleo rico em enxofre, nutrição do solo, etc.
Propriedades
Aparência física
Brisa sólida em poeira ou cristais. Sua cor é amarelo de limão opaco, é insípido e não tem cheiro.
Aparência líquida
O enxofre líquido é singular porque sua cor amarela inicial se torna avermelhada e intensifica e escurece se sofrer altas temperaturas. Quando ele queima, digamos chamas azuis e brilhantes.
Massa molar
32 g/mol.
Ponto de fusão
115.21ºC.
Ponto de ebulição
445ºC.
ponto de ignição
160ºC.
Temperatura de auto -ignição
232ºC.
Densidade
2.1 g/ml. No entanto, outros muitos podem ser menos densos.
Capacidade de calor molar
22,75 J/mol · k
Rádio covalente
105 ± 15 pm.
Eletro-negatividade
2.58 na escala Pauling.
Polaridade
Os links S-S são apolares porque ambos os átomos de enxofre têm a mesma eletronegatividade. Isso faz com que todos os seus Apotrópicos, cíclicos ou na forma de correntes, sejam apolares; E, portanto, suas interações com a água são ineficientes e não podem ser solubilizadas nele.
No entanto, o enxofre pode ser dissolvido em solventes apolares, como dissulfeto de carbono, cs2, e aromático (benzeno, tolueno, xileno, etc.).
Íons
O enxofre pode formar vários íons, geralmente ânions. O mais conhecido de todos é sulfeto, S2-. Os s2- É caracterizado por ser volumoso e uma base suave de Lewis.
Por ser uma base suave, a teoria estabelece que tendem a formar compostos com ácidos moles; Como cátions de metal de transição, incluindo fé2+, PB2+ e cu2+.
Estrutura e configuração eletrônica
A coroa de enxofre
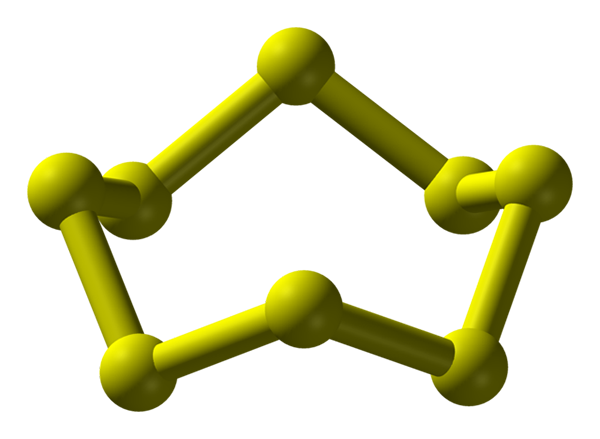 Molécula S8, a mais estável e abundante almotrópica de enxofre. Fonte: Benjah-BMM27.
Molécula S8, a mais estável e abundante almotrópica de enxofre. Fonte: Benjah-BMM27. O enxofre pode ocorrer em uma ampla variedade de muitos; e estes, por sua vez, têm estruturas cristalinas que são modificadas sob diferentes pressões e/ou temperaturas. Portanto, o enxofre é um elemento rico em alotopos e polimorfos, e o estudo de suas estruturas sólidas representa uma fonte interminável de obras teóricas-experimentais.
Por que essa complexidade estrutural? Para começar, as ligações covalentes em enxofre (S-S) são muito fortes, sendo superadas apenas por carbono, C-C e por hidrogênio, H-H.
O enxofre, diferentemente do carbono, não tende a formar tetraedros, mas bumerangues; que com seus ângulos eles dobram e tocam para estabilizar as correntes de enxofre. O anel mais conhecido de todos, representando também o alvo mais estável de enxofre, é o S8, A "coroa de enxofre" (imagem mais alta).
Observe que todos os links S-S8 Eles parecem bumerangues individuais, resultando em um anel com dobras e planos. Essas coroas s8 Eles interagem através das forças de Londres, orientadas de tal maneira que conseguem criar padrões estruturais que definem um cristal ortorrômbico; chamado s8 α (S-α, ou simplesmente enxofre ortorrômbico).
Pode atendê -lo: materiais elásticosPolymorphs
A coroa de enxofre é um dos muitos outros. Os s8 α é um polimorfo desta coroa. Existem outros dois (entre os mais importantes) chamados s8 β e s8 γ (S-β e S-γ, respectivamente). Ambos os polimorfos cristalizam em estruturas monoclínicas, sendo o S8 γ é mais denso (gama de enxofre).
Os três são sólidos amarelos. Mas como cada polimorfo é obtido separadamente?
Os s8 β prepara o S8 α a 93 ° C, permitindo que seu resfriamento lento diminua sua transição de retorno para a fase ortorrombic (o α). E os s8 γ, por outro lado, é obtido quando se baseia8 α a 150 ° C, permitindo esfriar novamente lentamente; É o mais denso dos polimorfos da coroa de enxofre.
Outros amores cíclicos
A coroa s8 Não é o único Alotrope Cíclico. Existem outros como S4, S5 (Analógico ao Cyclopentano), S6 (representado por um hexágono e também pelo ciclo), S7, S9, e s10-20; O último significa que pode haver anéis ou ciclos que contêm de dez a vinte átomos de enxofre.
Cada um deles representa diferentes amores de enxofre cíclicos; E, por sua vez, para enfatizá -lo, eles têm variedades de polimorfos ou estruturas polimórficas que dependem da pressão e temperatura.
Por exemplo, o S7 Possui até quatro polimorfos conhecidos: α, β, γ e δ. Os membros ou coroas de massas moleculares superiores são produtos de síntese orgânica e não predominam na natureza.
Correntes de enxofre
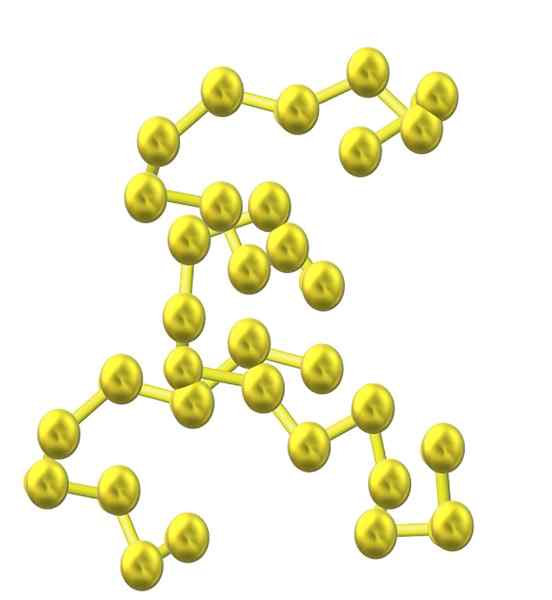 Cadeia de enxofre. Fonte: Opentax [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)]
Cadeia de enxofre. Fonte: Opentax [CC por 4.0 (https: // CreativeCommons.Org/licenças/por/4.0)] À medida que mais átomos de enxofre são incorporados à estrutura, sua tendência a anel diminui e as cadeias de enxofre permanecem abertas e adotam conformações helicoidais (como se fossem espirais ou parafusos).
E assim, surge outra família volumosa de alvo de enxofre que não consiste em anéis ou ciclos, mas de correntes (como a imagem superior).
Quando essas cadeias S-S se alinham em paralelo ao vidro, elas capturam impurezas e acabam definindo um sólido fibroso chamado enxofre fibroso, ou S-ψ. Se, entre essas cadeias paralelas, existem ligações covalentes que as interconectam (como com a vulcanização de borracha), temos enxofre laminar.
Quando enxofre s8 Derrete uma fase líquida amarelada que pode ficar escura se a temperatura for aumentada. Isso ocorre porque os links S-S estão quebrados e, portanto, ocorre um processo de despolimerização térmica.
Este líquido quando esfria mostra características plásticas e, em seguida, vítrea; isto é, um enxofre vítreo e amorfo (s) são obtidos. Sua composição consiste em anéis e correntes de enxofre.
E quando uma mistura de alotope fibrosa e laminar é obtida do enxofre amorfo, um produto comercial usado para a vulcanização de borracha.
Pequenos amadores
Embora tenham sido deixados por último, eles não são menos importantes (ou interessantes) do que os Alotropos das maiores massas moleculares. S2 e s3 são as versões sulfurizadas do O2 EU3. Nos dois primeiros átomos de enxofre, eles se juntam a uma ligação dupla, s = s e, no segundo, existem três átomos com estruturas de ressonância, s = s-s.
Ambos os s2 como o s3 Eles são gasosos. Os s3 Manifestar uma coloração vermelha cereja. Os dois têm material bibliográfico suficiente para cobrir um artigo individual.
Configuração eletronica
A configuração eletrônica para o átomo de enxofre é:
[NE] 3s2 3p4
Você pode ganhar dois elétrons para completar seu Octo de Valencia e, portanto, ter um estado de oxidação de -2. Da mesma forma, você pode perder elétrons, começando com dois em seus orbitais 3p, sendo seu estado de oxidação de +2; Se você perder mais dois elétrons, com seus orbitais 3P vazios, seu status de oxidação será +4; E se você perder todos os elétrons, será +6.
Pode atendê -lo: metalóidesObtendo onde está enxofre?
Mineralógico
Enxofre faz parte de muitos minerais. Entre eles estão o pirita (FES2), La Galena (PBS), Covellita (CUS) e outros minerais de sulfato e sulfetos. Ao processá -los, não apenas os metais podem ser extraídos, mas também enxofre após uma série de reações redutivas.
Também pode ser obtido puramente em aberturas vulcânicas, onde quando a temperatura é elevada e derrama ladeira abaixo; E se ele incendiar, ele parecerá uma lava azulada. Através de trabalhos árduos e trabalhos físicos extenuantes, o enxofre pode ser coletado, pois foi feito com bastante frequência na Sicília.
O enxofre também pode ser encontrado em minas subterrâneas, que são feitas para bombear água superaquecida para derreter e transferi -la para a superfície. Este processo de obtenção é conhecido como processo de Brasch, atualmente pouco usado.
Petróleo
Hoje, a maior parte do enxofre vem da indústria do petróleo, uma vez que seus compostos orgânicos fazem parte da composição do petróleo petrolífero e seus derivados refinados.
Se um petróleo ou produto refinado é rico em enxofre e sofrer hidrodesulfurização, ele liberará grandes quantidades de H2S (gás fedido que cheira a ovos podres):
R-S-R + 2 H2 → 2 rh + h2S
Então h2S é quimicamente no processo de Clauss, resumido com as seguintes equações químicas:
3 o2 + 2 h2S → 2 Então2 + 2 h2QUALQUER
SW2 + 2 h2S → 3 s + 2 h2QUALQUER
Formulários
Alguns dos usos para enxofre são mencionados abaixo e geralmente:
- É um elemento essencial para plantas e animais. Está até presente em dois aminoácidos: cisteína e métodina.
- É a matéria -prima para o ácido sulfúrico, composto na preparação de inúmeros produtos comerciais.
- Na indústria farmacêutica, é destinado à síntese de derivados de enxofre, sendo a penicilina a mais conhecida dos exemplos.
- Permite a vulcanização de borrachas interconectando cadeias poliméricas com links S-S.
- Suas cores e misturas amarelas com outros metais tornam desejável na indústria de pigmentos.
- Misturado com uma matriz inorgânica, como areia e rochas, asfalto de concreto e enxofre é preparado para a substituição do betume.
Riscos e precauções
O enxofre por conta própria é uma substância inofensiva e não -tóxica e também representa riscos potenciais, a menos que reagir para formar outros compostos. Seus sais de sulfato não são perigosos e podem ser manipulados sem grandes precauções. Isso não acontece, no entanto, com seus derivados gasosos: então2 e h2S, ambos extremamente tóxicos.
Se estiver em uma fase líquida, pode causar queimaduras sérias. Se se envolver em grandes quantidades, H pode desencadear2Está no intestino. Pelo resto, não representa nenhum risco para aqueles que mastigam.
Em termos gerais, o enxofre é um elemento claro que não requer muitas precauções, exceto mantê -lo longe do fogo e fortes agentes oxidantes.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- Laura Crapanzano. (2006). Polimorfismo de enxofre: aspectos estruturais e dinâmicos. Física [física].Universidade Joseph -Fourier - Grenoble I. Inglês. FFTEL-00204149F
- Wikipedia. (2019). Alotropes de enxofre. Recuperado de: em.Wikipedia.org
- Meyer bateu. (1976). Enxofre elementar. REVISÕES QUÍMICAS, VOL. 76, não. 3.
- Dr. Doug Stewart. (2019). Fatos do elemento de enxofre. Chemicool. Recuperado de: Chemicool.com
- Donald w. Davis e Randall um. Detro. (2015). História do enxofre. Georgia Gulf Sulphur Corporation. Recuperado de: Georgiagulfsulfur.com
- Helmestine, Anne Marie, Ph.D. (11 de janeiro de 2019). 10 fatos interessantes de enxofre. Recuperado de: pensamento.com
- Boone, c.; Vínculo, c.; Hallman, a.; Jenkins, J. (2017). Folha de fato do enxofre geral; Centro Nacional de Informações de Pesticidas, Serviços de Extensão da Universidade Estadual de Oregon. Npic.Orst.Edu
- « Independência das causas, desenvolvimento, consequências, personagens do México
- Flora e fauna de espécies representativas de Jalisco »

