Características de asparagina, estrutura, funções, biossíntese
- 5138
- 977
- Shawn Leffler
O Asparagina (Asn ou N) é um aminoácido importante para a sinalização celular e a união entre proteínas e carboidratos. Este é um dos 22 aminoácidos básicos e é catalogado como não -essencial, pois é sintetizado pelo corpo de mamíferos.
Este aminoácido é classificado dentro do grupo de aminoácidos polares sem carga e foi o primeiro aminoácido nu, fato que ocorreu em 1806, onde foi isolado do suco de aspargos (uma espécie de planta herbácea) pelos produtos químicos franceses vauquelin e Robiquet.
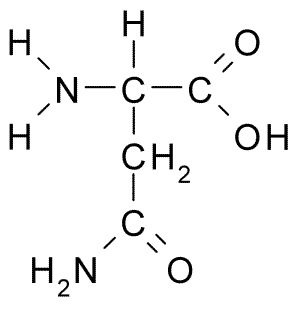
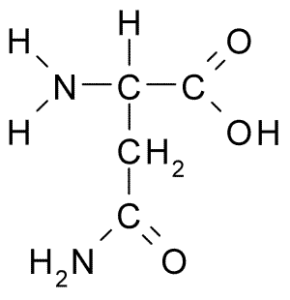 Estrutura química do aminoácido asparagina (Fonte: Borb, via Wikimedia Commons)
Estrutura química do aminoácido asparagina (Fonte: Borb, via Wikimedia Commons) Apesar de sua descoberta precoce, o papel biológico e nutricional da asparagina não foi reconhecido, mas mais de 100 anos depois, quando, em 1932, sua presença na estrutura de uma proteína presente nas sementes de cânhamo foi confirmada.
Asparagina e glutamina servem como substratos para os grupos de dois aminoácidos muito frequentes em proteínas: ácido aspártico (ácido aspártico) e glutamato (ácido glutâmico), respectivamente, respectivamente. Asparagina e glutamina são facilmente hidrolisadas nesses aminoácidos por ação enzimática ou ácido e compostos básicos.
Muitas enzimas serinas protease que são responsáveis por hidrolisando ligações peptídicas têm asparagina na cadeia lateral de seu local ativo. Este resíduo tem uma carga parcial negativa e é responsável por ingressar de maneira complementar com a carga positiva dos peptídeos brancos, aproximando -se do local de corte.
A enzima encarregada da síntese de oxalacetato da asparagina é usada em tratamentos quimioterapêuticos e é conhecida como L-asparaginase, responsável por catalisar a fragmentação hidrolítica da amida da asparagina ao aspartato e amônio.
A asparaginase é super-expressa e purificada de Escherichia coli, Ser injetado em pacientes infantis que têm leucemia linfoblástica aguda, uma vez que os linfócitos normais e malignos dependem da captura de asparagina no sangue para crescimento e multiplicação.
[TOC]
Características e estrutura
Todas as estruturas químicas dos aminoácidos têm um grupo carboxil (-coh), um grupo amino (-NH3+), um hidrogênio (-h) e um grupo R ou substituinte que são unidos pelo mesmo átomo de carbono, conhecido como carbono α.
Os aminoácidos diferem entre si pela identidade de suas cadeias laterais, que são conhecidas como grupos R e que podem variar em tamanho, estrutura, grupos funcionais e até carga elétrica.
Átomos de carbono de grupos R se identificam com cartas do alfabeto grego. Assim, no caso de asparagina, os carbonos da cadeia R são identificados como carbonos β e γ.
Pode atendê -lo: ágar xld: fundação, preparação e usosDe acordo com outro tipo de nomenclaturas, o átomo de carbono no grupo carboxila (-coh) está listado como C-1; portanto, continuando com a numeração, o carbono α seria C-2 e assim por diante.
Uma molécula de asparagina possui quatro átomos de carbono, incluindo α de carbono, carbono do grupo carboxil e dois átomos de carbono que fazem parte do grupo R, conhecido como carboxamida (-CH2-co-NH2).
Este grupo carboxamida é encontrado apenas em dois aminoácidos: em asparagina e glutamina. Tem a característica de formar pontes de hidrogênio com grande facilidade através do grupo amino (-NH2) e do grupo carbonil (-CO).
Classificação
A asparagina pertence ao grupo de aminoácidos polares sem carga, que são aminoácidos muito solúveis na água e muito hidrofílicos (devido à sua capacidade de formação de múltiplas pontes de hidrogênio).
No grupo de aminoácidos polares sem carga também são serina, treonina, cisteína e glutamina. Todos esses são compostos "Zwitteriônico”, Já que eles têm um grupo polar em sua cadeia R que contribui com a neutralização das cargas.
Todos os aminoácidos polares sem carga não são ionizáveis em pH próximo a 7 (neutro) ou seja, eles não têm cargas positivas ou negativas. No entanto, em meios ácidos e básicos, os substituintes são ionizados e adquirem um fardo.
Estereoquímica
O carbono central ou o carbono α dos aminoácidos é um carbono quiral; portanto, possui quatro substituintes unidos diferentes, o que causa pelo menos dois estereoisômeros distinguíveis para cada aminoácido.
Estereoisômeros são imagens especulares de uma molécula que possui a mesma fórmula molecular, mas não são mais favoráveis entre si, como mãos (esquerda e direita). Eles são indicados com a letra D ou L, uma vez que experimentalmente as soluções desses aminoácidos giram o plano de luz polarizado em direções opostas.
A assimetria geral dos aminoácidos torna a estereoquímica desses compostos de grande importância, uma vez que cada um tem propriedades diferentes, é sintetizado e participa de diferentes rotas metabólicas.
A asparagina pode ser encontrada na forma D-asparagina ou L-asparagina, sendo este último a mais frequente de natureza. É sintetizado pela L-syntesease e metabolizado para L-asparaginase, ambas as enzimas são muito abundantes no fígado do vertebrado.
Funções
A facilidade de formar pontes de hidrogênio de asparagina o torna um aminoácido crucial para a estabilidade estrutural das proteínas, pois pode formar pontes internas de hidrogênio com as correntes laterais dos outros aminoácidos que os inventam.
Pode atendê -lo: 25 exemplos de reprodução assexualA asparagina é geralmente encontrada na superfície do meio aquoso típico, estabilizando sua estrutura.
Muitas glicoproteínas podem se ligar a carboidratos ou carboidratos através de um resíduo de asparagina, treonina ou serina. No caso da asparagina, uma acetil galactosamina é geralmente unida ao grupo amino por n-glicicosilação.
É importante destacar que em todas as glicoproteínas N-glicosiladas os carboidratos se ligam a eles através de um resíduo de asparagina que está em uma região específica denotada como ASN-X-SER/THR, onde x é qualquer aminoácido.
Essas glicoproteínas são montadas no retículo endoplasmático, onde são glicosiladas à medida que são traduzidas.
Biossíntese
Todos os organismos eucarióticos assimilam a amônia e transformam-a em glutamato, glutamina, carbamílio-fosfato e asparagina. A asparagina pode ser sintetizada a partir de intermediários glicolíticos, no ciclo do ácido cítrico (de oxalacetato) ou dos precursores consumidos na dieta.
A enzima de asparagina sintetase é uma amidotransferase dependente de glutamina e ATP que o ATP e o pirofosfato inorgânico (PPI) cospe e usa a amônia ou glutamina para catalisar uma reação de amidação e converter o aspartato em asparagina.
Tanto as bactérias quanto os animais têm uma asparagina sintetase, no entanto, em bactérias, a enzima usa o íon amônio como doador de nitrogênio, enquanto em mamíferos a sintetica sintetária usa glutamina como doador principal do grupo nitrogênio.
A ruptura enzimática do ATP para amplificador e pirofosfato inorgânico (PPI), juntamente com a glutamina como doador do grupo amida, são as principais diferenças em relação à biossíntese de L-glutamina entre os diferentes organismos.
Degradação
A maioria dos estudos sobre metabolismo de asparagina foi realizada em plantas, tendo em vista o fato de que os estudos inicialmente em mamíferos foram prejudicados pela falta de metodologias sensíveis o suficiente para testes de aminoácidos no nível de sistemas mais complexos.
A L-asparagina é constantemente hidrolisada em mamíferos pela L-asparaginase para causar ácido aspártico e amônio. É usado para síntese de glicoproteínas e é um dos principais precursores do oxalacetato para o ciclo do ácido cítrico.
A enzima de asparaginase catalisa a hidrólise de asparagina para aspartato, posteriormente aspartato é transaminado com α-cetoglutarato para produzir glutamato e oxalacetato.
Pode atendê -lo: epiblastoA asparagina sinteta, também conhecida como aspartato-amonias ligase, é encontrada abundantemente de células cerebrais de mamíferos.
Quando baixos níveis dessa enzima são percebidos no corpo, o que é conhecido como "aminoacidopatias" é formado, à medida que os substratos precursores se acumulam no citoplasma das células cerebrais.
Alimentos ricos em asparagina
As pessoas que têm leucemia linfoblástica aguda geralmente têm deficiências em relação à enzima de asparagina sintetase e dependem da asparagina em circulação, de modo que recomendam uma dieta em alimentos ricos em asparagina ou o suprimento exógeno do mesmo.
Entre os múltiplos alimentos com alto teor de asparagina, ela está.
Existem concentrados de asparagina L que são formulados para atletas de alta concorrência, uma vez que seu consumo ajuda a regenerar as proteínas que compõem os tecidos.
Além disso, as pessoas que têm déficit na síntese de aminoácidos também ingerem esses comprimidos para evitar distúrbios em seu sistema nervoso central.
A asparagina é mais fácil de metabolizar através de sua forma de asparagina L, uma vez que muitas das enzimas envolvidas em seu metabolismo não reconhecem a forma de asparagina D e, portanto, nem todas asparaginas ingeridas em alimentos estão disponíveis para diferentes processos de organismo.
A abundante ingestão de asparagina pode ser benéfica, no entanto, é recomendável que não.
Referências
- Cooney, d. PARA., Capizzi, r. eu., & Handschumacher, r. E. (1970). Avaliação do metabolismo de L-asparagina em animes e homem. Pesquisa sobre câncer, 30 (4), 929-935
- Dunlop, p. C., Roon, r. J., E até, H. eu. (1976). Uso de D-asparagina por Saccharomyces cerevisiae. Jornal de Bacteriologia, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, f. (2017). Avanços no metabolismo da asparagina. Em Progresso na botânica Vol. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, r., & Kornfeld, S. (1985). Montagem de oligossacarídeos ligados a asparagina. Revisão anual de bioquímica, 54 (1), 631-664
- Mathews, c. K., & Ahern, k. G. (2002). Bioquímica. Pearson Education.
- Nelson, d. eu., Lehninger, a. eu., & Cox, M. M. (2008). Lehninger Principles of Biochemistry. Macmillan.
- Yamada, k., Hashizume, d., Shimizu, t., & Yokoyama, S. (2007). L-Asparagine. Ato cristalográfico Seção E: Relatórios de estrutura online, 63 (9), 3802-3803.
- « Características do ácido glutâmico, funções, biossíntese
- Características de mãos, estrutura, funções »

