Antraceno o que é, estrutura, propriedades, usa
- 2161
- 444
- Terrell Stokes
Ele Antraceno É um hidrocarboneto aromático policíclico (HAP) formado pela fusão de três anéis de benzeno. É um composto incolor, mas sob a irradiação da luz ultravioleta adquire uma cor azul fluorescente. O antraceno sublima facilmente.
É um sólido branco, mas também pode ocorrer como cristais incolores não colínicos, de um cheiro aromático suave. O sólido antraceno é praticamente insolúvel na água e é parcialmente solúvel em solventes orgânicos, especialmente em dissulfeto de carbono, CS2.
Foi descoberto em 1832 em agosto Laurent e Jean Dumas, usando o alcatrão como matéria -prima. Este material continua a ser usado na produção de antraceno, pois contém 1,5 % do composto aromático. Também pode ser sintetizado a partir de benzoquinona.
É encontrado no ambiente como um produto da combustão parcial de hidrocarbonetos fósseis. Foi encontrado na água potável, no ar atmosférico, nas fugas dos veículos a motor e na fumaça dos cigarros. Aparece na lista da EPA (Agência de Proteção Ambiental dos Estados Unidos) dos poluentes ambientais mais importantes.
Estrutura do antraceno
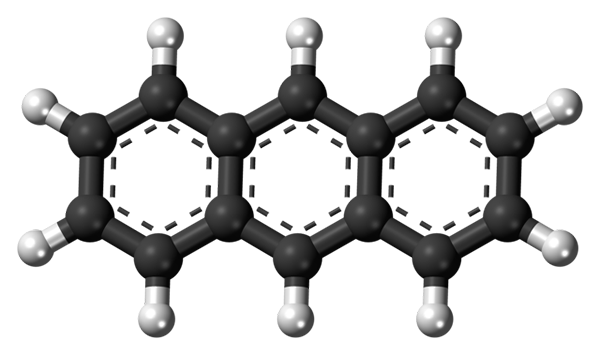 Os três anéis aromáticos do antraceno. Fonte: Jynto [CC0]
Os três anéis aromáticos do antraceno. Fonte: Jynto [CC0] A imagem superior mostra a estrutura do antraceno representado com um modelo de esferas e barras. Como pode ser visto, existem três anéis aromáticos de seis carbonos; Estes são anéis de benzeno. As linhas pontilhadas indicam a aromaticidade presente na estrutura.
Todos os carbonos têm hibridação SP2, Então a molécula está no mesmo avião. Portanto, o antraceno pode ser considerado como uma folha pequena e aromática.
Observe que os átomos de hidrogênio (esferas brancas) são praticamente descobertos na frente de uma série de reações químicas.
Forças intermoleculares e estrutura cristalina
Antraceno. Por exemplo, você pode ver que duas dessas "folhas" se juntam e movem os elétrons de sua nuvem π (os centros aromáticos dos anéis), eles conseguem se manter juntos.
Outra interação possível é que os hidrogênios, com uma certa carga parcial positiva, são atraídos para os centros negativos e aromáticos das moléculas de Anthract vizinhas. E, portanto, essas atrações exercem um efeito direcional que guia as moléculas de antracia no espaço.
Pode atendê -lo: velocidade constanteAssim, o antraceno é ordenado de tal maneira que adote um padrão de estrutura de longa faixa; E, portanto, pode cristalizar em um sistema monoclínico.
Presumivelmente, esses cristais exibem cores amareladas de sua oxidação em Antraquinona; que é um derivado do antraceno cujo sólido é amarelo.
Propriedades
Nomes químicos
-Antraceno
-Paranaftaleno
-Antracina
-Óleo verde
Fórmula molecular
C14H10 ou (c6H4CH)2.
Peso molecular
178.234 g/mol.
Descrição física
Sólido branco ou pálido. Cristais monoclínicos Produto da recristalização em álcool.
Cor
Quando é puro, o antraceno é incolor. Com cristais amarelos amarelos amarelos dão fluorescência de uma cor azul. Você também pode apresentar certos tons amarelados.
Cheiro
Aromático macio.
Ponto de ebulição
341.3 ºC.
Ponto de fusão
216 ºC.
ponto de ignição
250 ºF (121 ºC), copo fechado.
Solubilidade em água
Praticamente insolúvel em água.
0.022 mg/l de água a 0 ºC
0044 mg/l de água a 25ºC.
Solubilidade de etanol
0,76 g/kg a 16ºC
3,28 g/kg a 25 ° C. Observe como é mais solúvel em etanol do que na água na mesma temperatura.
Solubilidade em Hexano
3,7 g/kg.
Solubilidade em benzeno
16,3 g/l. Sua maior solubilidade no benzeno mostra sua alta afinidade por ele, já que ambas as substâncias são aromáticas e cíclicas.
Solubilidade de dissulfeto de carbono
32,25 g/l.
Densidade
1,24 g/cm3 a 68 ºf (1,25 g/cm3 a 23ºC).
Densidade de vapor
6,15 (com o ar tomado como referência igual a 1).
Pressão de vapor
1 mmhg a 293 ºF (sublima). 6,56 x 10-6 mmhg a 25 ºC.
Estabilidade
É estável se armazenado nas condições recomendadas. É triboluminescente e triboelétrico; Isso significa que emite luz e eletricidade quando esfrega. O antraceno escurece quando exposto à luz solar.
Auto-direção
1.004 ºF (540 ºC).
Decomposição
Compostos perigosos por combustão (óxidos de carbono) são produzidos. Ele se decompõe quando aquecido sob a influência de oxidantes fortes, produzindo um acre e fumaça tóxica.
Pode atendê -lo: nitrobenzeno (c6h5n2): estrutura, propriedades, usos, riscosCalor de combustão
40.110 kJ/kg.
Capacidade calórica
210.5 J/mol · k.
Comprimento de onda máxima de absorção (luz visível e ultravioleta)
Máximo λ 345,6 nm e 363,2 nm.
Gosma
-0,602 CPOISE (240 ºC)
-0,498 CPOISE (270 ºC)
-0,429 CPOISE (300 ° C)
Como pode ser visto, sua viscosidade diminui à medida que a temperatura aumenta.
Nomenclatura
A Antrachen é uma molécula policiclica uniforme e, de acordo com a nomenclatura estabelecida para esse tipo de sistema, seu nome real deve ser tricen. O prefixo TRI se deve ao fato de haver três anéis beanscênicos. No entanto, o nome trivial antraceno se estendeu e enraizado na cultura popular e científica.
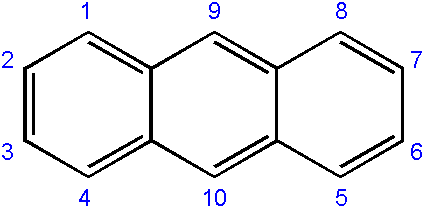
A nomenclatura dos compostos derivados é geralmente um pouco complexa e depende do carbono onde a substituição ocorre. A seguir, mostra a respectiva numeração de carbonos para Anthract:
 Numeração de carbonos em antraceno. Fonte: Edgar181 [Domínio Público]
Numeração de carbonos em antraceno. Fonte: Edgar181 [Domínio Público] A ordem de numeração se deve à prioridade da reatividade ou suscetibilidade dos referidos carbonos.
Os carbonos das extremidades (1-4 e 8-5) são os mais reativos, enquanto os do meio (9-10) reagem por outras condições; Por exemplo, oxidativo, para formar a antraquinona (9, 10-dioxontraCeno).
Toxicidade
Em contato com a pele, pode causar irritação, coceira e queima, que pioram com a luz do sol. Antrachen é o fotossensibilizador, o que aumenta os danos causados pela pele causados pela radiação UV. Pode causar dermatite aguda, teangiectasia e alergia.
Em contato com os olhos, isso pode causar irritação e queimar. Respirar o antraceno pode irritar o nariz, a garganta e os pulmões, causando tosse e chiado.
A ingestão de antraceno tem sido associada a humanos com dor de cabeça, náusea, perda de apetite, inflamação do trato gastrointestinal, reações lentas e fraqueza.
Houve sugestões de ação de câncer de antraceno. No entanto, essa presunção não foi corroborada, incluindo alguns derivados do antraceno foram usados no tratamento de certos tipos de câncer.
Formulários
Tecnológica
-O Antrachen é um semicondutor orgânico, usado como spinder em fótons de alta energia, elétrons e partículas alfa.
-Também é usado para revestimento de plástico, como poliviniltolueno. Isso para produzir espistas de plástico, com características semelhantes a água, para usá -lo na dosimetria de radioterapia.
Pode atendê -lo: Piperidina: estrutura, síntese, derivados, reações-O antraceno é comumente usado como um plotador de radiação UV, aplicado em revestimentos em placas de circuito impresso. Isso permite inspecionar o forro com luz ultravioleta.
Molécula padrão
Em 2005, os químicos da Universidade da Califórnia, Riverside, sintetizaram a primeira molécula padrão: 9.10-ditioantratona. Isso é empurrado em uma linha reta quando é aquecida em uma superfície plana de cobre e pode se mover como se tivesse dois pés.
Os pesquisadores pensaram que a molécula era potencialmente utilizável na computação molecular.
Piezocromaticity
Alguns derivados do antraceno têm propriedades piezocromáticas, ou seja, eles têm a capacidade de mudar de cor, dependendo da pressão que é aplicada. Portanto, eles podem ser usados como detectores de pressão.
O antraceno também é usado na elaboração das telas de fumaça de So So.
Ecológico
Os hidrocarbonetos aromáticos políticos (HAP) são poluentes ambientais, principalmente da água; portanto, são feitos esforços para reduzir a presença tóxica desses compostos.
O Antracen é um material (HAP) e é usado como modelo, para estudar a aplicação do método de pirólise da água na degradação de compostos de PAH.
A pirólise da água é usada no tratamento de água industrial. Sua ação no antraceno produziu a formação de compostos de oxidação: Antron.
Esses produtos são menos estáveis que o antraceno e, portanto, são menos persistentes no ambiente, sendo capazes de ser mais facilmente eliminados do que os compostos de PAH.
Outros
-O antraceno oxida para originar a antroquinona, usada na síntese de corantes e corantes
-O antraceno é usado na proteção de madeira. Também é usado como inseticida, derrame, herbicida e raticida.
-O antibiótico antraciclina tem sido usado na quimioterapia, pois inibe a síntese de DNA e RNA. A molécula de antraciclina é intercalada entre as bases de DNA/RNA, inibindo a replicação de células cancerígenas em rápido crescimento.
Referências
- Antraceno. Recuperado de: em.Wikipedia.org
- Antraceno. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov

