Características Alfa Amilasa, Estrutura, Funções
- 2994
- 626
- Ralph Kohler
O Alfa Amilasa (α-amilase) é uma enzima amilolítica do grupo endo amilasas responsável pela hidrólise das ligações α-1,4 entre os resíduos de glicose que compõem diferentes tipos de carboidratos na natureza.
Sistematicamente conhecido como sistematicamente conhecido como α-1,4-glucan. Nos seres humanos, por exemplo, as amilases presentes na saliva e as secretadas pelo pâncreas são do tipo α-amilases.
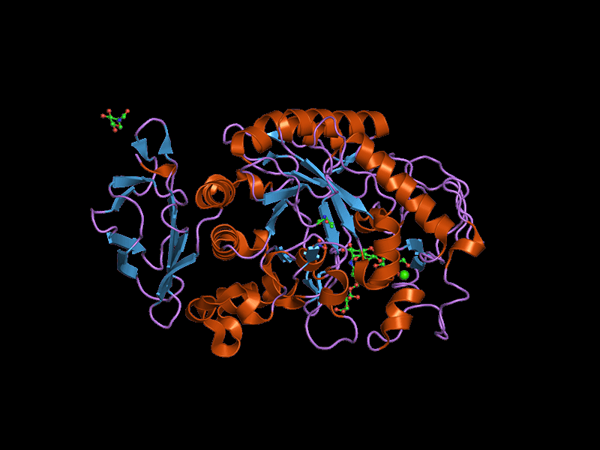
 Estrutura do domínio C-terminal do animal Alfa Amilasa (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons) via Wikimedia Commons)
Estrutura do domínio C-terminal do animal Alfa Amilasa (Fonte: Jawahar Swaminathan e MSD funcionários do Instituto Europeu de Bioinformática [domínio público] via Wikimedia Commons) via Wikimedia Commons) Kuhn, em 1925, foi o primeiro a cunhar o termo "α-amilase" com base no fato de que os produtos de hidrólise que catalisam essas enzimas têm configuração α. Mais tarde, em 1968, foi determinado que estes agirem de preferência em substratos de configuração estrutural linear e não ramificados.
Como outras enzimas amilolíticas, a α-amilase é responsável pela hidrólise do amido e outras moléculas relacionadas, como glicogênio, produzindo polímeros menores compostos por unidades repetidas de glicose.
Além das funções fisiológicas que essa enzima possui em animais, plantas e microorganismos que a expressam, a α-amilase, juntamente com as outras classes de amilases existentes, representam 25% das enzimas usadas para fins industriais e biotecnológicos.
Muitas espécies de fungos e bactérias são a principal fonte de obtenção das α-amilases que são usadas com mais frequência na indústria e experimentação científica. Isso se deve principalmente à sua versatilidade, à sua obtenção fácil, ao seu gerenciamento simples e aos baixos custos relacionados à sua produção.
[TOC]
Caracteristicas
As α-amilases encontradas na natureza podem ter faixas de pH ideais de pH muito diferente para sua operação; Por exemplo, ideal para animais e plantas de α-amilases está entre 5.5 e 8.0 unidades de pH, mas algumas bactérias e fungos têm mais enzimas alcalinas e mais ácidas.
Pode atendê -lo: filogeniaAs enzimas presentes na saliva e no pâncreas de mamíferos funcionam melhor em pH perto de 7 (neutro), além disso, exigem íons de cloreto para alcançar sua atividade enzimática máxima e são capazes de ingressar nos íons de cálcio divalentes.
Ambos os animais, enzimas salivares e pancreáticas são produzidas em organismos por mecanismos independentes que envolvem células e glândulas específicas e que provavelmente não estão relacionadas às enzimas presentes na torrente circulatória e em outras cavidades do corpo.
Tanto o pH quanto a temperatura ideal para o funcionamento dessas enzimas depende muito da fisiologia do organismo que é considerado, uma vez que existem microorganismos extremofílicos que crescem em condições muito particulares em relação a esses e muitos outros parâmetros.
Finalmente, em termos de regulação de sua atividade, uma característica compartilhada entre as enzimas do grupo de α-amilases é que essas, como outras amilases, podem ser inibidas por íons de metais pesados, como mercúrio, cobre, prata e chumbo.
Estrutura
A α-amilase é uma enzima multidomínio que, em animais e plantas, possui um peso molecular aproximado de 50 kDa e diferentes autores concordam que as enzimas pertencentes a essa família de glico-hidrolesase são enzimas com mais de dez domínios estruturais.
O domínio central ou o domínio catalítico é muito preservado e é conhecido como domínio A, que consiste em uma dobra simétrica de 8 folhas banhadas β organizadas na forma de um "barril" cercado por 8 salas alfa, para que você também possa encontrar Na literatura, como (β/α) 8 ou "Tim", barril.
É importante observar que no extremo C-terminal das folhas β do domínio A estão os resíduos de aminoácidos preservados envolvidos na catálise e na junção do substrato e que esse domínio está localizado na região N-terminal de a proteína.
Pode atendê -lo: fauna e flora do mar peruanoOutro dos domínios mais estudados dessas enzimas é o chamado Ding B, que se destaca entre a lâmina pendurada por β e a hélice alfa número 3 do domínio a. Isso desempenha um papel fundamental na união de substrato e cálcio divalente.
Domínios adicionais foram descritos para enzimas α-amylass, como domínios C, D, F, G, H e I, que estão localizados na frente ou nas costas do domínio A e cujas funções não são conhecidas exatamente e dependem do organismo que é estudado.
α-amilases de microorganismos
O peso molecular das α-amilases depende, bem como outras características bioquímicas e estruturais, sobre o organismo que é estudado. Assim, as α-amilases de muitos fungos e bactérias têm pesos tão baixos quanto 10 kDa e até 210 kDa.
O alto peso molecular de algumas dessas enzimas microbianas está frequentemente relacionado à presença de glicosilação, embora a glicosilação da proteína em bactérias seja bastante rara.
Funções
Nos animais, as α-amilases são responsáveis pelos primeiros passos no metabolismo do amido e do glicogênio, pois são responsáveis por sua hidrólise a fragmentos menores. Os órgãos do sistema gastrointestinal encarregado de sua produção em mamíferos são o pâncreas e as glândulas salivares.
Além de sua óbvia função metabólica, a produção de α-amilases produzidas pelas glândulas salivares de muitos mamíferos, ativada pela ação da norepinefrina, é considerada por muitos autores como um importante marcador de tensão "psicobiológico" no estresse no sistema nervoso central.
Ele também tem funções secundárias na saúde bucal, pois sua atividade funciona na eliminação de bactérias orais e na prevenção de sua adesão a superfícies orais.
Pode servir a você: Especiação simpática: conceito, características e exemplosFunção principal em plantas
Nas plantas, as α-amilases desempenham um papel principal na germinação de sementes, pois são as enzimas que hidrolisam o amido presente no endosperma que nutre o embrião dentro, processo essencialmente controlado pela giberelina, um filtromônio.
Aplicações industriais
As enzimas pertencentes à família de α-amilases têm várias aplicações em muitos contextos diferentes: industrial, científico e biotecnológico, etc.
Nas grandes indústrias de processamento de amido, as α-amilases são usadas popularmente para produção de glicose e frutose, bem como para a produção de pão com texturas aprimoradas e com maior capacidade fiel.
No campo biotecnológico, existe muito interesse em relação à melhoria das enzimas usadas comercialmente, a fim de melhorar sua estabilidade e desempenho em diferentes condições.
Referências
- Aiyer, p. V. (2005). Amilases e suas aplicações. Jornal Africano de Biotecnologia, 4(13), 1525-1529.
- Bernfeld, p. (1960). Amilases, A e B. Em Enzimas do metabolismo de carboidratos (Vol. Eu, pp. 149-158).
- Granger, d. PARA., Kivighan, k. T., Eles., Gordis, e. B., & Stud, L. R. (2007). Salivar A-Andlase na pesquisa biobehavioral. Desenvolvimentos e aplicações recentes. Ann. N.E. Acade. Sci., 1098, 122-144.
- Monteiro, p., & Oliveira, P. (2010). Aplicação de A-Andlase Microbial na indústria- uma revisão. Jornal brasileiro de microbiologia, 41, 850-861.
- Reddy, n. S., Nimmagadda, a., & Rao, K. R. S. S. (2003). Uma visão geral da família microbiana α-amor. Jornal Africano de Biotecnologia, 2(12), 645-648.
- Sal, w., & Shenker, S. (1976). Amilase- seu significado clínico: uma revisão da literatura. Medicamento, 55(4), 269-289.
- Svensson, b., & MacGregor, e. PARA. (2001). Relação de sequência e estrutura com a especificidade na família de enzimas a-amilase. Biochimica et biophysica Acta, 1546, 1-20.
- Thoma, j. PARA., Spradlin, J. E., & Dygert, S. (1925). Amilases de plantas e animais. Ann. Chem., 1, 115-189.
- « Estrutura renina, produção, secreção, funções
- Urie Bronfenbrenner Biografia, Modelo Ecológico e Contribuições »

