Características de Adenilato Ciclasa, Tipos, Funções
- 3160
- 16
- Conrad Schmidt
O Cyclasa adenilato qualquer adenilciclase É a enzima responsável pela conversão de ATP, uma molécula de alta energia, em amplificador cíclico, uma importante molécula de sinalização que ativa várias proteínas AMP dependentes cíclicas com importantes funções fisiológicas.
Sua atividade é controlada por vários fatores, como a ação concertada de hormônios, neurotransmissores e outras moléculas reguladoras de natureza diferente (íons de cálcio divalentes e proteínas G, para citar alguns).
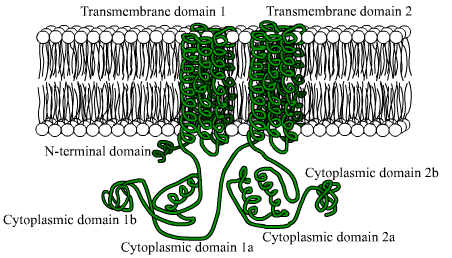
 Diagrama de adenilato de Cyclasa (Fonte: Usuário BensAccount on.Wikipedia [domínio público] via Wikimedia Commons)
Diagrama de adenilato de Cyclasa (Fonte: Usuário BensAccount on.Wikipedia [domínio público] via Wikimedia Commons) A principal importância dessa enzima está na transcendência do produto da reação que catalisa, o amplificador cíclico, pois participa do controle de muitos fenômenos celulares relacionados ao metabolismo e desenvolvimento, bem como com a resposta a diferentes estímulos externos.
Na natureza, tanto os organismos unicelulares (relativamente simples) quanto os animais multicelulares grandes e complexos, usam um amplificador cíclico como segundo mensageiro e, portanto, para as enzimas que o produzem.
Estudos filogenéticos estabelecem que essas enzimas derivam de um ancestral comum antes da separação de eubactérias e eucariotos, o que sugere que o amplificador cíclico teve funções diferentes, talvez relacionadas à produção de ATP.
É possível aceitar tal afirmação, uma vez que a reação catalisada pela adenilato ciclase é facilmente reversível, o que pode ser notado na constante de equilíbrio para a síntese de ATP (KEq ≈ 2.1 ± 0.2 10-9 M2).
[TOC]
Características e estrutura
A maioria das enzimas de adenilato de ciclast eucariótico está associada à membrana plasmática, mas nas bactérias e nas células espermáticas de mamíferos são encontradas como proteínas solúveis no citosol.
Em leveduras e algumas bactérias são proteínas da membrana periférica, enquanto em certas espécies de ameba, são moléculas com um único segmento transmembranal.
Características estruturais
São proteínas compostas de grandes cadeias polipeptídicas (de mais de 1.000 resíduos de aminoácidos), que atravessam a membrana plasmática 12 vezes por meio de duas regiões compostas por seis domínios transmembranares de conformação alfa.
Cada região transmembranal é separada por um grande domínio citosólico, responsável pela atividade catalítica.
Pode servir você: flora e fauna da África: espécies representativasEntre os organismos eucarióticos, existem algumas razões preservadas em um fragmento da região terminal amino dessas enzimas, bem como um domínio citoplasmático de cerca de 40 kDa, que é delimitado pelas seções hidrofóbicas.
Local catalítico
A reação que essas enzimas catalisam, ou seja, a formação de uma ligação da dieta através de um ataque nucleofílico do grupo OH na posição 3 'do grupo fosfato do trfosfato de nucleosídeo na posição 5', depende de um motivo estrutural comum conhecido como o Palma de domínio ".
Este domínio de "Palma" é composto por uma razão "βαβαβ"(" Β "querendo denotar as folhas β e" α "para hélices alfa) e possui dois resíduos de ácidos asparáveis invariáveis que coordenam os dois íons metálicos responsáveis pela catálise, que podem ser divalentes de magnésio ou magnésio zinco zinco.
Muitos estudos relacionados à estrutura quaternária dessas enzimas revelaram que sua unidade catalítica existe como um dímero cuja formação depende dos segmentos transmembranais, que são coletados no retículo endoplasmático durante a formação da proteína.
Localização
Foi determinado que, como muitas proteínas abrangentes da membrana, como proteínas G, aquelas com âncoras de fosfatidilinositol e muitas outras, adenilcics são encontradas em regiões ou micro domínios especiais de membrana conhecidos como "lipídios lipídicos" (do inglês "Jangada lipídica").
Esses domínios de membrana podem ter até centenas de nanômetros de diâmetro e são compostos principalmente de colesterol e esfingolipídios com cadeias de ácidos graxos predominantemente saturados e um longo comprimento longo, o que faz com que eles tenham menos fluidez e permitirem o acomodar os segmentos transmembranares de diferentes proteínas.
O adenilato de Cyclasas também se viu associado a sub -regiões de jangadas lipídicas conhecidas como "caveolas" (inglês "Caveolae "), que são invaginações da membrana rica em colesterol e uma proteína associada a isso que é chamada caveolina.
Pessoal
Na natureza, existem três tipos de adenilato de ciclasses bem definidos e dois que estão sujeitos a discussão.
Pode atendê -lo: oxihemoglobina: características, estrutura e curva de união- Classe I: Eles estão presentes em muitas bactérias gram -negativas, como E. coli, Por exemplo, onde o produto da AMP cíclico da reação tem funções como o ligante para fatores de transcrição responsáveis pela regulação das operações catabólicas.
- Classe II: Eles são encontrados em alguns patógenos de gêneros de bactérias, como Bacilo qualquer Bordetella, onde eles servem como toxinas extracelulares. São proteínas ativadas pelo hospedeiro calmodulina (ausente em bactérias).
- Classe III: Eles são conhecidos como classe "universal" e estão relacionados filogeneticamente às Guanilaato Cyclasas, que cumprem funções semelhantes. Eles são encontrados em procariontes e eucaryotas, onde são regulamentados por diferentes estradas.
Ciclasas de mamíferos de adenilato
Nos mamíferos, pelo menos nove tipos dessas enzimas foram clonados e descritos.
Essas compartilham estruturas complexas e topologias de membrana, bem como domínios catalíticos duplicados que são característicos deles.
Para mamíferos, a nomenclatura usada para se referir a isoformas corresponde a letras CA (por Cyclasa adenilato) e para um número de 1 a 9 (AC1 - AC9). Duas variantes da enzima AC8 também foram relatadas.
As isoformas presentes nesses animais são contrapartes em relação à sequência da estrutura primária de seus locais catalíticos e da estrutura tridimensional. A inclusão de uma dessas enzimas dentro de cada "tipo" está principalmente relacionada aos mecanismos de regulação que operam em cada isoforma.
Eles têm padrões de expressão que geralmente são específicos de tecido. No cérebro, você pode encontrar todas as isoformas, embora algumas sejam restritas a áreas específicas do sistema nervoso central.
Funções
A principal função das enzimas pertencentes à família de adenilato de cylasa é transformar o ATP em amplificador cíclico e, para isso, catalisam a formação de um dietista intramolecular Link 3 ' - 5' (reação semelhante à catalisada pelas polimerases de DNA), com com a a liberação de uma molécula de pirofosfato.
Nos mamíferos, as diferentes variantes que podem ser alcançadas foram associadas à proliferação celular, dependência de etanol, plasticidade sináptica, dependência de drogas, ritmo circadiano, estimulação olfativa, aprendizado e memória.
Pode atendê -lo: parasitismo: conceito, tipos e exemplosAlguns autores afirmaram que o adenilato Cyclasas pode ter uma função adicional, como moléculas de transporte ou, que é a mesma, proteínas de canal e transportadores iônicos.
No entanto, essas hipóteses só foram comprovadas, dependendo do arranjo ou da topologia dos segmentos transmembranares dessas enzimas, que compartilham algumas homologias estruturais ou semelhanças (mas não sequência) com certos canais de transporte de íons.
Tanto o AMP cíclico quanto o PPI (pirofosfato), que são os produtos da reação, têm funções no nível celular; Mas sua importância depende do organismo onde eles estão.
Regulamento
A grande diversidade estrutural entre os adenilciclasses demonstra uma grande suscetibilidade a várias formas de regulação, o que lhes permite integrar -se a uma variedade de rotas de sinalização celular.
A atividade catalítica de algumas dessas enzimas depende de cetoácidos alfa, enquanto outros têm mecanismos de regulação muito mais complexos que envolvem subunidades regulatórias (por estimulação ou inibição) que dependem, por exemplo, de cálcio e outros fatores geralmente solúveis, bem como de outros outros proteínas.
Muitos adenilados de ciclasas são regulados negativamente por subunidades de algumas proteínas G (inibem sua função), enquanto outros exercem ativadores bastante.
Referências
- Cooper, d. M. F. (2003). Regulamentação e organização de ciclasses e acampamento de adenilylil. Jornal Bioquímico, 375, 517-529.
- Cooper, d., Mons, n., & Karpen, J. (novecentos e noventa e cinco). Ciclases de adenilil e a interação entre cálcio e sigal de acampamento. Natureza, 374, 421-424.
- Danchin, a. (1993). Filogenia de ciclasses de adenilil. Avanços na pesquisa de segundo mensageiro e fosfoproteínas, 27, 109-135.
- Hanoune, J., & Adiar, n. (2001). Regulação e papel das isoformas da adenilil ciclase. Ann. Rev. Pharmacol. Toxicol., 41, 145-174.
- Borda, u., & Schultz, J. E. (2003). Os ciclasses de adenilil Classe III: módulos de sinalização multiuso. Sinalização celular, quinze, 1081-1089.
- Tang, w., & Gilman, para. G. (1992). Ciclases de adenilil. Célula, 70, 669-672.
- « Difração do som do que consiste, exemplos, aplicações
- Antecedentes da Aliança de Papai Noel, objetivos, consequências »

