Estrutura de acetato de sódio, propriedades, síntese, usos

- 1868
- 496
- Ralph Kohler
Ele acetato de sódio É um sal de sódio de ácido acético cuja fórmula molecular é C2H3QUALQUER2N / D. Consiste em um pó branco delicado, presente essencialmente em duas formas: anidro e tri -hidrato. Ambos são muito solúveis em água, o solvente universal; Mas não tão solúvel em álcoois ou acetona.
A forma de Anhydra tem uma densidade, um ponto de ebulição e fusão com valores mais altos do que os apresentados pela forma tri -hidratada de acetato de sódio. Isso ocorre porque as moléculas de água interferem entre as interações de íons Na+ e cap3COO-.
 Aparência de acetato de sódio
Aparência de acetato de sódio O acetato de sódio é estável, especialmente se for armazenado entre 2 e 8 ºC; Mas é suscetível à ação de fortes agentes oxidantes e halogênios.
Pode ser preparado pela reação do bicarbonato de sódio com ácido acético. Além disso, com a reação do ácido acético com hidróxido de sódio. Ambas as reações são simples de elaborar e baixo custo econômico; O primeiro pode ser feito em casa.
Este sal é um pouco tóxico composto. Produz uma irritação da pele, somente após um contato frequente e contínuo. É um pouco irritante para os olhos, mas pode irritar as vias aéreas. Não há informações sobre um efeito prejudicial de sua ingestão.
Possui numerosos usos e aplicações, destacando sua função de amortecimento de pH, juntamente com ácido acético. O amortecedor de acetato tem um PKA = 4,7; que confere alta eficiência na regulação do pH em um ambiente ácido com valores de pH entre 3 e 6.
Devido à sua baixa toxicidade e às suas propriedades, ele tem sido amplamente usado para melhorar o sabor dos alimentos, bem como um agente que fornece proteção contra sua decomposição devido à sua ação contra micróbios.
[TOC]
Estrutura de acetato de sódio
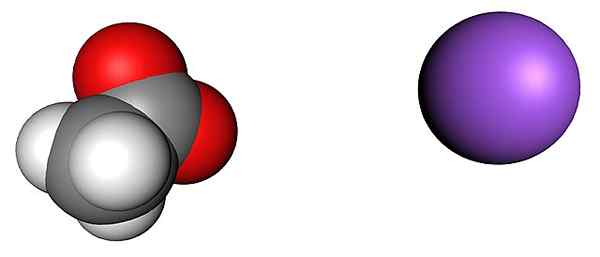 Acetato e íons de sódio. Fonte: shu0309 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)]
Acetato e íons de sódio. Fonte: shu0309 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] A imagem superior mostra os íons que compõem os cristais anidros de acetato de sódio (sem água). A esfera roxa corresponde à náutica+, E o íon molecular à sua esquerda é acetato, Cho3COO-, Com seus átomos de oxigênio representados por esferas vermelhas.
Esses colegas, de acordo com o chip CH3Caminho, estão em uma proporção 1: 1; Para cada CHO3COO-, Deve haver um cátion+ atraído por sua carga negativa e vice -versa. Assim, atrações entre eles e repulsões entre cargas iguais, acabam estabelecendo padrões estruturais que definem um cristal, cuja expressão mínima é a célula unitária.
Essa célula unitária, como o vidro como um todo, varia dependendo da disposição dos íons no espaço; Nem sempre é o mesmo, mesmo para o mesmo sistema cristalino. Por exemplo, o acetato de sódio anidro pode formar dois polimorfos ortorrômbicos, um dos quais é representado abaixo:
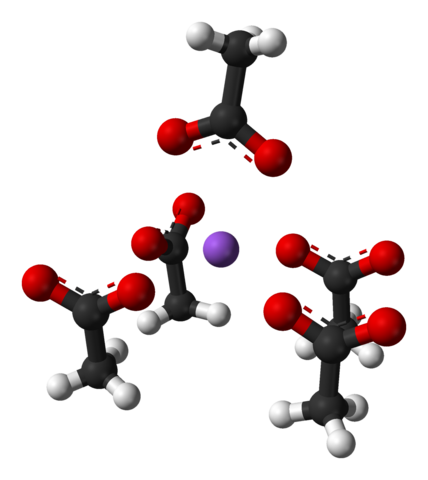 Célula unitária de cristais ortorrômicos de acetato de sódio. Fonte: Benjah-BMM27 [Domínio Público]
Célula unitária de cristais ortorrômicos de acetato de sódio. Fonte: Benjah-BMM27 [Domínio Público] Observe o arranjo dos íons: quatro íons3COO- Eles incluem um na+ De tal maneira que eles "desenham" uma pirâmide de base quadrada distorcida. Cada um deles3COO- Por sua vez, interaja com outro NA+ adjacente.
Cristais hidratados
O acetato de sódio tem muita afinidade pela água; De fato, é delicioso, isto é, mantém a umidade até que seja dissolvido no mesmo. Quanto maior a umidade, mais cedo é "derrete". Isso é porque assim3COO- Como na+ Eles podem hidratar, cercar -se de moléculas de água que guiam seus dipolos em direção a suas cargas (na na+ Oh2, CH3COO- Hoh).
Pode servir a você: brometo de prata (AGBR): estrutura, propriedades e usosQuando esse sal é preparado em laboratório ou em casa, é uma afinidade pela água que, mesmo em temperaturas normais, já é obtida como hidrato; o ch3Pata · 3h2QUALQUER. Seus cristais deixam de ser ortorrômbicos e se tornarem monoclínicos, pois agora incorporam três moléculas de água para cada par Cho3COO- e na+.
Propriedades
Nomes
-Acetato de sódio.
-Etanoato de sódio (IUPAC).
Massa molar
-ANYDROUS: 82,03 g/mol.
-Tri -hidratado: 136,03 g/mol.
Aspecto
Delicuescentes pó branco.
Cheiro
Para vinagre quando ele é aquecido para decomposição.
Densidade
-Anhidro: 1, 528 g/cm3 A 20 ºC.
-Tri -hidratado: 1,45 g/cm3 A 20 ºC.
Ponto de fusão
-Anhidro: 324 ºC (615 ºF, 597 K).
-Triohydrate: 58 ºC (136 ºF, 331 K).
Ponto de ebulição
-Anhidro: 881,4 ºC (1.618,5 ºf, 1.154,5 k).
-Tri -hidrato: 122 ºC (252 ºF, 395 K). Se decompõe.
Solubilidade
Na água
-Anhydro: 123,3 g/100 ml a 20ºC.
-Tri -hidratado: 46,4 g/100 ml a 20 ºC.
Em metanol
16 g/100 g a 15 ºC.
Em etanol
5,3 g/100 ml (tri -hidrato).
Em acetona
0,5 g/kg a 15 ° C.
Acidez
PKA: 24 (20 ºC).
Basicidade
PKB: 9.25. Aqui é evidente que o acetato de sódio é um sal básico para ter que ter PKB menor que o seu PKA.
Índice de refração (ηd)
1.464
Capacidade calórica
-100,83 J/mol · k (anidro).
-229,9 J/mol · k (Tri -hydrado).
ponto de ignição
Mais de 250ºC.
Temperatura de auto -ignição
600 ºC.
ph
8,9 (solução de 0,1 m a 25 ºC).
Estabilidade
Estábulo. Incompatível com agentes oxidantes fortes e halogênio. Umidade.
Reações
O acetato de sódio pode formar um éster reagindo com um halogeneto de aluguel; Por exemplo, Bromoetano:
CH3PORON +BRCH2CH3 => Cap3Cooch2CH3 + Nabr
O acetato de sódio é descarboxyla para formar metano (pirólise) na presença de NaOH:
CH3Poon +Naoh => ch4 + N / D2Co3
A reação é catalisada pelas vendas da CESIO.
Síntese
O acetato de sódio pode ser produzido a baixo custo em laboratório, reagindo bicarbonato de sódio com ácido acético:
Nahco3 + CH3COOH => CH3Caminho +h2Co3
Esta reação é acompanhada pela presença na solução de uma bolha intensa, devido à decomposição do ácido carbônico em água e dióxido de carbono.
H2Co3 => H2Ou +co2
Industrialmente, o acetato de sódio é produzido pela reação do ácido acético com hidróxido de sódio.
CH3COOH +NAOH => CH3Caminho +h2QUALQUER
Formulários
Sacos térmicos
O acetato de sódio é usado para a fabricação de sacos térmicos.
Inicialmente, os cristais de sal são dissolvidos em um volume de água para a preparação de uma solução que se torne supersaturada.
Então a solução de uma temperatura superior a 58 ºC é aquecida, que é o seu ponto de fusão. A solução supersaturada à temperatura ambiente é deixada esfriar e a formação de cristais não é observada; A solução acabou -chirp.
Pode atendê -lo: tabela periódica, para que éA ausência de cristais é explicada que as moléculas líquidas são muito confusas e não têm devido orientação para alcançar a temperatura de cristalização. O líquido está em um estado metaestável, um estado de desequilíbrio.
Dar. No caso de sacos térmicos, uma fixação mecânica é pressionada para mexer o líquido e iniciar a formação de cristais e a solidificação da solução de acetato de sódio tri -hidratado.
À medida que a cristalização ocorre, a temperatura está aumentando. Os cristais de acetato de sódio tri -hidratado adquirem a aparência do gelo, mas são quentes, por isso é chamado de "gelo quente".
Industriais
-O acetato de sódio é usado na indústria têxtil como mordente no processo de coloração de tecidos
-Neutralizar resíduos de ácido sulfúrico
-Possui uso no processamento de algodão para a elaboração de algodão, utilizável em limpeza pessoal e para fins médicos
-É usado em decapagem de metal, antes de seu cromo
-Colabora para que a vulcanização do cloropreno não ocorra no processo de produção de borracha sintética
-Intervém na purificação da glicose
-É usado em peles bronzeando.
Uso médico
O acetato de sódio faz parte dos compostos usados para fornecer eletrólitos administrados aos pacientes por via intravenosa.
É usado para corrigir os níveis de sódio em pacientes hiponáticos, também na correção da acidose metabólica e da alcalinação da urina.
Solução de amortecimento de pH
É usado como um regulador de pH em muitas reações enzimáticas que ocorrem entre pH 3 e pH 6.
O pH diferente da solução tampão de acetato é alcançado pela variação da concentração de ácido acético e acetato de sódio.
Por exemplo, para obter um pH 4,5, a solução tampão possui uma concentração de ácido acético de 3,8 g/L e uma concentração de acetato de sódio anidro de 3,0 g/L.
A concentração da solução tampão de acetato pode ser aumentada, aumentando na mesma proporção os componentes da solução necessária para obter o pH desejado.
O absorvedor de choque de acetato/acetonitrila é usado na eletroforese capilar na separação de fotoberberina.
Laboratórios de pesquisa
-O acetato de sódio é um agente nucleofílico fraco que é usado na polimerização aniônica de β-lactona.
-É usado como reagente na ressonância magnética nuclear de macromoléculas biológicas.
-É usado na extração das células das células. O sódio é um cátion que interage com as cargas negativas de fosfatos presentes no DNA, o que ajuda em sua condensação. Na presença de etanol, o DNA forma um precipitado que pode ser separado na camada aquosa.
Conservação de Alimentos
-Ajuda a prevenir o crescimento bacteriano, além de impedir a geração de excesso de acidez que causa deterioração dos alimentos, mantendo assim um pH específico.
-O sódio presente no acetato aumenta o sabor da comida.
-O acetato de sódio é usado na preparação de picles vegetais: pepino, cenoura, cebola, etc. Além disso, é usado na conservação de carne.
Pode atendê -lo: dimetilanilina: estrutura, propriedades, síntese, usosConservação de concreto
O concreto é danificado pela ação da água que diminui sua duração. O acetato de sódio atua como um agente de selante de concreto que o impermeabiliza, prolongando suas características iniciais.
Jovens experimentos
Experiência 1
Um experimento simples é a síntese de acetato de sódio através da reação de bicarbonato de sódio com vinagre (5%de ácido acético).
30 ml de vinagre são colocados em um copo e aproximadamente 3,5 g de bicarbonato são adicionados.
Na reação, as formas de sódio e ácido carbônico são formadas. O ácido é dividido em dióxido de carbono e água. A geração de dióxido de carbono produzirá uma bolha intensa dentro da solução.
Para coletar acetato de sódio, a evaporação da água é causada, aquecendo a solução.
Experiência 2
Outro experimento simples é a formação de acetato de tri -hidrato de sódio.
Para fazer isso, cerca de 20 g de acetato de sódio tri -hidrato e colocado em um copo, depois adicionando 10 ml de água e, em seguida, adicionando 10 ml de água. A solução é aquecida a uma temperatura superior a 58 ºC.
O acetato de sódio é completamente dissolvido para garantir que a solução seja supersaturada. Anteriormente, uma cápsula Pietri é colocada em uma superfície fria.
O conteúdo do copo com acetato de tri -hidrato na cápsula de Pietri é derramado lentamente. A temperatura líquida na cápsula começa a descer, mesmo sob o ponto de fusão, sem observar a cristalização ou solidificação do acetato de sódio tri -hidrato.
Geralmente para produzir a cristalização de acetato de sódio tri -hidratado, uma pequena quantidade de sal é adicionada para servir como um núcleo de cristalização. Outras vezes, há um pequeno distúrbio da solução, para iniciar a cristalização do acetato de sódio.
Os cristais de acetato de sódio tri -hidratado se parecem com o gelo, mas se forem tocados, será notado que eles estão relativamente quentes. Por esse motivo, o sal é chamado de "gelo quente".
Toxicidade
O acetato de sódio é um composto muito pouco tóxico. Nem é classificado como um sensibilizador para a pele e as vias aéreas.
Além disso, o acetato de sódio não é classificado como um agente mutagênico no germe, carcinogênio ou células tóxicas para reprodução.
Em suma, é um pouco irritante para os olhos. As vias aéreas podem ficar irritadas após sua inalação. O contato frequente e constante com a pele pode causar sua irritação.
Referências
- Shiver & Atkins. (2008). Química Inorgânica. (Quarta edição). Mc Graw Hill.
- WorldOfchemicals. (16 de janeiro de 2017). Como preparar acetato de sódio em casa? Recuperado de: médio.com
- Centro Nacional de Informações sobre Biotecnologia. (2019). Acetato de sódio. Banco de dados PubChem. CID = 517045. Recuperado de: pubchem.NCBI.Nlm.NIH.Gov
- S. Cameron, k. M. Mannan e m. QUALQUER. Rahman. (1976). A estrutura cristalina do acetato de sódio trihidrato. CRIST ACT. B32, 87.
- Wikipedia. (2019). Acetato de sódio. Recuperado de: em.Wikipedia.org
- Helmestine, Anne Marie, Ph.D. (24 de janeiro de 2019). Faça gelo quente com vinagre e bicarbonato de sódio. Recuperado de: pensamento.com
- Livro químico. (2017). Acetato de sódio. Recuperado de: ChemicalBook.com
- Wasserman Robin. (2019). Usos de acetato de sódio. Recuperado de: Livestrong.com
- DrugBank. (2019). Acetato de sódio. Recuperado de: Drugbank.AC
- « Batalha dos exércitos, desenvolvimento, consequências do termopista
- O experimento Oersted e Faraday »

