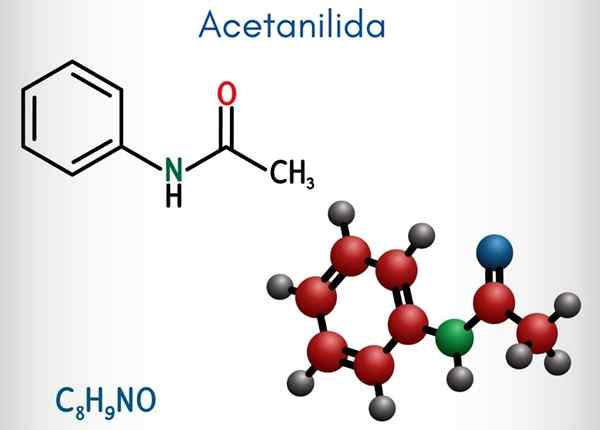
Acetanilida (C8H9NO)
- 4929
- 64
- Conrad Schmidt
O que é acetanilídeo?
O Acetanilido (C8H9Não) É uma amida aromática que recebe vários nomes adicionais: n-acetilarilamina, n-feenilacetamida e atetanil. É apresentado como um banheiro sólido na forma de flocos, sua natureza química é amida e, como tal, pode formar gases inflamáveis ao reagir com agentes fortes redutores.
Além disso, é uma base fraca, sendo capaz de reagir com agentes desidratados como P2QUALQUER5 Para originar um nitrilo. Verificou -se que o acetanilido tinha uma ação analgésica e antipirética e foi usada em 1886 com o nome de Antifebrin por um. Cahn e p. Hepp.
Em 1899, o ácido acetilsalicílico (aspirina) foi introduzido no mercado, que tinha as mesmas ações terapêuticas que a acetanilida. Quando o uso de acetanilido está relacionado ao aparecimento de cianose em pacientes - uma consequência de metaglobinemia induzida por acetanilido - seu uso foi descartado.
Posteriormente, foi estabelecido que a ação analgésica e antipirética do acetanilídeo residia em um metabolito desse paracetamol chamado (acetoaminofeno), que não teve seus efeitos tóxicos, como Axelrod e Brodie sugeriram.
Estrutura química

Na imagem superior, a estrutura química do acetanilido é representada. À direita está o anel aromático hexagonal do benzeno (com linhas pontilhadas), e a esquerda é a razão pela qual o composto consiste em uma amida aromática: o grupo acetamida (HnCoch3).
O grupo acetamida dá ao anel benzeno um caráter polar maior; Isto é, crie um momento dipolar na molécula de atetanilide.
Porque? Porque o nitrogênio é mais eletronegativo do que qualquer um dos átomos de carbono do anel e também está ligado ao grupo acila, cujo átomo ou também atrai densidade eletrônica.
Pode atendê -lo: uretano: estrutura, propriedades, obtenção, usosPor outro lado, quase toda a estrutura molecular do acetanilido repousa no mesmo plano devido à hibridação do SP2 dos átomos que o compõem.
Há uma exceção ligada àquelas do grupo -ch3, cujos átomos de hidrogênio compõem os vértices de um tetraedro (as esferas brancas da extremidade esquerda deixam o avião).
Estruturas de ressonância e interações intermoleculares
O torque solitário sem compartilhar o átomo de n circula através do sistema π do anel aromático, originando várias estruturas de ressonância. No entanto, uma dessas estruturas termina com a carga negativa no átomo de O (mais eletronegativo) e uma carga positiva no átomo de n.
Assim, existem estruturas de ressonância onde uma carga negativa se move no anel, e outra onde reside no átomo de ou. Como conseqüência dessa "assimetria eletrônica"-que vem da mão da assimetria molecular-, o acetanilido interage intermolecularmente pelas forças dipolo-dipolo.
No entanto, as interações de pontes de hidrogênio (n-h-o…) entre duas moléculas de acetanilido são, de fato, a força predominante em sua estrutura cristalina.
Dessa forma, os cristais de acetanilídeo consistem em células unitárias ortorrombic de oito moléculas orientadas com formas de "fitas planas" por suas pontes de hidrogênio.
O exposto acima pode ser visualizado se uma molécula de acetanilide for colocada em cima do outro, em paralelo. Então, como grupos HNCoch3 Eles se sobrepõem com espaço, formam pontes de hidrogênio.
Além disso, entre essas duas moléculas, ele também pode "ser roubado" um terço, mas com seu anel aromático apontando para o lado oposto.
Pode atendê -lo: bromotimol azulPropriedades químicas de Acetanilido
 Aparência do apelo
Aparência do apelo Peso molecular
135.166 g/mol.
Descrição química
Sólido branco ou acinzentado. Formar flocos brancos brilhantes ou um pó branco cristalino.
Cheiro
Lavatório.
Sabor
Um pouco picante.
Ponto de ebulição
304 ºC a 760 mmHg (579 ºF a 760 mmHg).
Ponto de fusão
114,3 ºC (237,7 ºF).
Flash ou inflamabilidade
169 ºC (337 ºF). Medição feita em vidro aberto.
Densidade
1,219 mg/ml a 15 ° C (1.219 mg/ml a 59 ºf)
Densidade do vapor
4.65 com relação aérea.
Pressão de vapor
1 mmHg a 237 ºF, 1,22 × 10-3 mmHg a 25 ºC, 2a a 20 ° C.
Estabilidade
Sofra um retroglo químico quando exposto à luz ultravioleta. Como a estrutura muda? O grupo acetil forma novos links no ringue nas posições da Ortho e para. Além disso, é estável no ar e incompatível com fortes agentes oxidantes, cáusticos e álcalis.
Volatilidade
Consideravelmente volátil a 95 ºC.
Auto-direção
1004 ºF.
Decomposição
Ele se decompõe quando aquecido, emitindo uma fumaça altamente tóxica.
ph
5 - 7 (10 g/l de H2Ou 25 ºC)
Solubilidade
- Em água: 6,93 × 103 mg/ml a 25 ° C.
- 1 g de solubilidade do acetanilido em diferentes líquidos: em 3,4 ml de álcool, 20 ml de água fervente, 3 ml de metanol, 4 ml de acetona, 0,6 ml de álcool fervendo, 3,7 ml de clorofórmio, 5 ml de gliecerol, 8 ml de dioxan, 47 ml de benzeno e 18 éter. O hidrato de cloral aumenta a solubilidade do acetanilido na água.
Síntese
É sintetizado reagindo anidrido acético com acetanilido. Esta reação aparece em muitos textos de química orgânica (Vogel, 1959):
C6H5NH2 + (CH3CO)2O => C6H5NHCOCH3 + CH3COOH
Pode atendê -lo: bórax: história, estrutura, propriedades, usos, síntese, riscosFormulários
- É um agente inibidor do processo de decomposição de peróxido de hidrogênio (peróxido de hidrogênio).
- Estabilizar os vernizes do éster de celulose.
- Intervém como intermediário na aceleração da produção de borracha. Da mesma forma, é intermediário na síntese de alguns corantes e na cânfora.
- Atua como um precursor na síntese de penicilina.
- É usado na produção de cloreto de 4-acetamidefonilbenzeno. O acetanilido reage com ácido clorossulfônico (HSO3Cl), produzindo assim o cloreto de 4-aminossulfonilbenzeno. Isso reage com amônio ou amina orgânica primária para formar sulfonamidas.
- Foi usado experimentalmente no século XIX no desenvolvimento da fotografia.
- O acetanilido é usado como um marcador de fluxos eletroosmóticos (EOF) em eletroforese capilar para o estudo da ligação entre medicamentos e proteínas.
- Recentemente, 1- (ω-fenoxialkiluracilo) uniu inibição em experimentos de inibição de experimentos de inibição do vírus da hepatite C. O acetanilido se junta à posição 3 do anel de pirimidina.
- Resultados experimentais indicam uma redução na replicação do genoma viral, independentemente do genótipo viral.
- Antes de identificar a toxicidade do acetanilido, foi usado como analgésico e antipirético de 1886. Posteriormente (1891), foi usado no tratamento de bronquite crônica e aguda por Grün.