Absorção molar
- 1226
- 281
- Terrell Stokes
O que é absorção molar?
O Absorção molar É uma propriedade química que indica quanta luz pode absorver uma espécie em solução. Isto é, é uma unidade que mede a capacidade de uma solução de absorver luz.
Como a luz consiste em fótons com energia (ou comprimentos de onda), dependendo da espécie ou mistura mista, um fóton pode ser absorvido em um grau maior do que outro. Significa que a luz é absorvida em certos comprimentos de onda característicos da substância.
Assim, o valor da absorção molar é diretamente proporcional ao grau de absorção de luz a um certo comprimento de onda. Se a espécie absorve pouca luz vermelha, seu valor absorvente será baixo. Se houver uma absorção pronunciada da luz vermelha, a absorção terá um alto valor.
Uma espécie que absorve a luz vermelha refletirá uma cor verde. Se a cor verde é muito intensa e escura, significa que há uma forte absorção de luz vermelha.
No entanto, alguns tons verdes podem ser devidos aos reflexos de diferentes faixas de amarelo e azul, que são misturadas e percebidas como verde turquesa, esmeralda, vidro, etc.
Equação de absorção molar
A absorção molar é uma constante definida na expressão matemática da lei de Lambert-Beer e simplesmente aponta quanta luz absorve a espécie química ou a mistura. A equação é:
A = εbc
Onde A é a absorvância da solução para um comprimento de onda λ selecionado, B é o comprimento da célula em que a amostra a ser analisada está contida e, portanto, é a distância que a luz passa dentro da solução, C é o concentração das espécies absorventes e ε, absorvente molar.
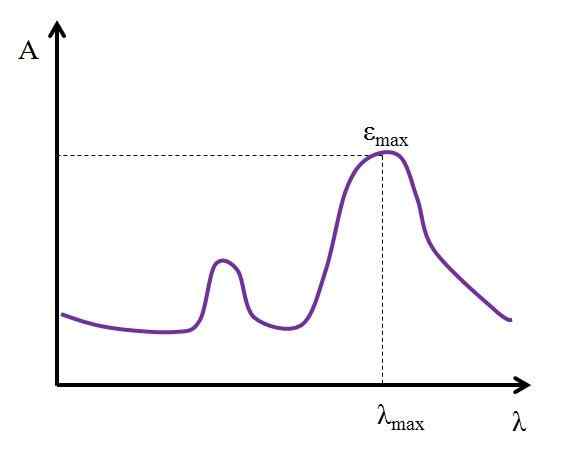
Pode servir você: AlquinosDado λ, expresso em nanômetros, o valor de ε permanece constante. Mas, alterando os valores de λ, ou seja, medindo absorvâncias com luzes de outras energias, ε muda, atingindo um valor mínimo ou máximo.
Se seu valor máximo for conhecido, εMáx, É determinado ao mesmo tempo λMáx. Isto é, a luz que mais absorve as espécies:
 Gráfico onde os valores máximos de absorção de luz de uma espécie química são mostrados. Fonte: Gabriel Bolívar
Gráfico onde os valores máximos de absorção de luz de uma espécie química são mostrados. Fonte: Gabriel Bolívar Unidades
Para conhecer as unidades de ε, devemos saber que os absorvâncias são valores sem dimensão e, portanto, a multiplicação das unidades B e C deve ser anulada.
A concentração das espécies absorventes pode ser expressa em G/L ou Mol/L, e B geralmente expressa em CM ou M (porque é o comprimento da célula que cruza o feixe de luz). A molaridade é igual a mol/l, então C também é expressa como M.
Assim, multiplicar as unidades B e C é obtido: M ∙ cm. As unidades que ε devem ter que deixar o valor de A são aquelas que multiplicar.
Limpando você, você é simplesmente obtido m-1∙ CM-1, que também pode ser escrito como: l ∙ mol-1∙ CM-1.
De fato, use M unidades-1∙ CM-1 ou l ∙ mol-1∙ CM-1 acelera os cálculos para determinar a absorção molar. No entanto, também é geralmente expresso com m unidades2/mol ou cm2/mol.
Quando expresso com essas unidades, alguns fatores de conversão devem ser usados para modificar as unidades B e C.
Como calcular a absorção molar?
Liberação direta
A absorção molar pode ser calculada diretamente por sua limpeza na equação anterior:
Pode atendê -lo: ácidos e bases na vida cotidiana: reações, usos, exemplosε = a/bc
Se a concentração da espécie absorvente for conhecida, o comprimento da célula e qual é a absorvância obtida em um comprimento de onda, poderá ser calculada ε. No entanto, essa maneira de calcular produz um valor imprecionado e não confiável.
Método gráfico
Se a equação da lei de Lambert-Beer for observada cuidadosamente, será observado que ela se assemelha à equação de uma linha (y = ax+b).
Isso significa que se os valores de eixo A forem gráficos. Assim, seria y, x seria C, e seria equivalente a εb.
Portanto, o gráfico de linha, basta levar dois pontos para determinar a inclinação, isto é, para. Uma vez feito isso, e o comprimento da célula, B, é fácil limpar o valor de ε.
Ao contrário da liberação direta, gráfico vs. C permite que você medem medidas de absorvância média e reduza o erro experimental e, também, através de um único ponto, eles podem passar infinitos retos; portanto, a liberação direta não é prática.
Além disso, erros experimentais podem fazer uma linha não passam por dois, três ou mais pontos; portanto, a linha obtida após a aplicação do método mínimo quadrado é realmente usado (função que já está incorporada às calculadoras).
Tudo isso assumindo uma alta linearidade e, portanto, conformidade com a lei de Lamber-Beer.
Exercícios resolvidos
Exercício 1
Sabe -se que uma solução de um composto orgânico com uma concentração de 0.008739 m apresentou uma absorvância de 0.6346, medido em λ = 500 nm e com uma célula de 0.5 cm de comprimento. Calcule qual é a absorção molar do complexo ao referido comprimento de onda.
Pode atendê -lo: níquel: história, propriedades, estrutura, usos, riscosA partir desses dados, pode ser liberado diretamente ε:
ε = 0.6346/(0.5 cm) (0.008739 m)
145.23 m-1∙ CM-1
Exercício 2
As seguintes absorvâncias medidas em diferentes concentrações de um complexo metálico a um comprimento de onda de 460 nm e com uma célula de 1 cm de comprimento: Comprimento:
A: 0.03010 0.1033 0.1584 0.3961 0.8093
C: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2.3 ∙ 10-4 5.6 ∙ 10-4
Calcule a absorção molar do complexo.
Há um total de cinco pontos. Para calcular ε, é necessário representá -los colocando os valores de um no eixo y. Uma vez feito isso, a linha dos quadrados mínimos é determinada e, com sua equação, ela pode ser determinada ε.
Nesse caso, os pontos gráficos e desenharam a linha com um coeficiente de determinação r2 de 0.9905, a inclinação é igual a 7 ∙ 10-4, isto é, εb = 7 ∙ 10-4.
Portanto, com b = 1cm, ε será 1428,57 m-1.cm-1 (1/7 ∙ 10-4).
Referências
- Coeficiente de atenuação molar. Recuperado de.Wikipedia.org
- Science Struct. Absorção molar. Recuperado de Sciencestruck.com
- Análise Colorimétrica (Lei da Cerveja ou Análise Espectrofotométrica). Química recuperada.UCLA.Edu

