Absorvância o que é, exemplos e exercícios resolvidos
- 4225
- 1301
- Terrence King IV
O absorvância É o logaritmo com um sinal negativo do quociente entre a intensidade da luz emergente e a intensidade do incidente da luz em uma amostra de solução translúcida que foi iluminada com luz monocromática. Este quociente é o transmitância.
O processo físico da passagem da luz através de uma amostra é chamado transmissão luminosa, E a absorvância é uma medida disso. Portanto, a absorvância se torna o menor logaritmo de transmitância e é um fato importante para determinar a concentração de uma amostra que geralmente é dissolvida em um solvente como água, álcool ou qualquer outro.
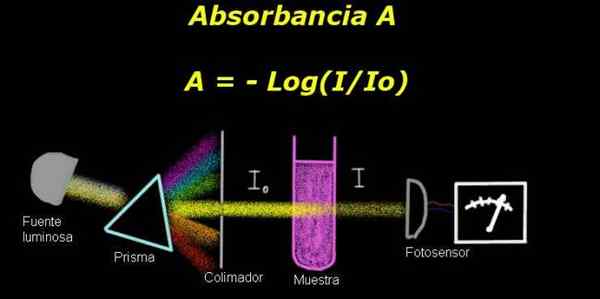
 figura 1. Esquema do processo de absorvância. Preparado por f. Zapata
figura 1. Esquema do processo de absorvância. Preparado por f. Zapata Para medir a absorvância, é necessário um dispositivo Eletro-fotômetro, com o qual uma corrente é medida proporcional ao incidente de intensidade luminosa em sua superfície.
Ao calcular a transmitância, o sinal da intensidade correspondente ao solvente sozinho é geralmente medido e esse resultado é registrado como Io.
Então a amostra dissolvida no solvente com as mesmas condições de iluminação é colocada. A medida medida pelo eletro-fotômetro é denotada como Yo, que permite que você calcule a transmitância T De acordo com a seguinte fórmula:
T = i / iqualquer
É uma quantidade desencadeada. O Absorvância a Isso é expresso como:
A = - log (t) = - log (i / iqualquer)
[TOC]
Absorvância molar e absorção
As moléculas que compõem um produto químico são capazes de absorver a luz, e uma medida disso é com precisão. É o resultado da interação entre fótons e elétrons moleculares.
Portanto, é uma magnitude que dependerá da densidade ou concentração das moléculas que compõem a amostra e também do caminho óptico ou distância percorrida pela luz.
Você pode atendê -lo: terceira lei de Newton: pedidos, experimentos e exercíciosDados experimentais indicam que a absorvora PARA é linearmente proporcional à concentração C e distância d A luz viajou. Portanto, para calculá -lo com base nesses parâmetros, a seguinte fórmula pode ser estabelecida:
A = ε⋅c⋅d
Na fórmula anterior, ε É uma constante de proporcionalidade conhecida pelo nome de Absorção molar.
A absorção molar depende do tipo de substância e comprimento de onda com o qual a absorvância é medida. O Absorção molar Também é sensível à temperatura da amostra e ao pH do mesmo.
Lei de Beer-Lambert
Essa relação entre absorvância, absorção, concentração e distância da espessura do caminho que a luz segue dentro da amostra é conhecida como Lei de Beer-Lambert.
 Figura 2. Lei de Cerveja - Lambert. Fonte: f. Zapata,
Figura 2. Lei de Cerveja - Lambert. Fonte: f. Zapata, Abaixo, existem alguns exemplos de como usá -lo.
Exemplos
Exemplo 1
Durante um experimento, uma amostra com uma luz vermelha de uma luz de laser de hélio-neon, cujo comprimento de onda é 633 nm. Um eletro-fotômetro mede 30 mV quando a luz do laser afeta diretamente e 10 mV quando passa por uma amostra.
Nesse caso, a transmitância é:
T = i / io = 10 mV / 30 mV = ⅓.
E a absorvância é:
A = - log (⅓) = log (3) = 0,48
Exemplo 2
Se a mesma substância for colocada em recipiente que tem metade do espesso.
Deve -se considerar que, se a espessura diminuir para a metade, a absorvância proporcional à espessura óptica diminui pela metade, ou seja, a = 0,28. A transmitância de toneladas será dada pelo seguinte relacionamento:
Pode servir a você: Tiro vertical: fórmulas, equações, exemplosT = 10-a = 10^(-0.28) = 0,53
O eletro-fotômetro marcará 0,53*30 mV = 15,74 mV.
Exercícios resolvidos
Exercício 1
É desejado determinar a absorção molar de um certo composto patenteado que está em solução. Para isso, a solução com luz de uma lâmpada de sódio de 589 nm é iluminada. A amostra será colocada com 1,50 cm de espessura.
É baseado em uma solução de concentração 4,00 × 10^-4 moles por litro e a transmitância é medida, resultando em 0,06. Determinar com esses dados a absorção molar da amostra.
Solução
Em primeiro lugar, a absorvância é determinada, o que é definido como o menor logaritmo baseado em dez de transmitância:
A = - log (t)
A = - log (0,06) = 1,22
Em seguida, é usada a lei de Lambert-Beer que estabelece uma relação entre absorvância, absorção molar, concentração e comprimento óptico:
A = ε⋅c⋅d
Limpando a absorção molar O seguinte relacionamento é obtido:
ε = a/(c⋅d)
Substituindo os valores fornecidos:
ε = 1,22/(4,00 × 10^-4 m⋅1,5 cm) = 2030 (m⋅cm)^-1
O resultado anterior foi arredondado para três dígitos significativos.
Exercício 2
Para melhorar a precisão e determinar o erro da medida da absorção molar da amostra no Exercício 1, a amostra é sucessivamente diluída na metade da concentração e a transmitância é medida em cada caso.
A partir de CO = 4 × 10^-4 m com transmitância t = 0,06 A seguinte sequência de dados para transmitância e absorvância calculada a partir da transmitância é obtida:
CO/1-> 0,06-> 1,22
CO/2-> 0,25-> 0,60
CO/4-> 0,50-> 0,30
CO/8-> 0,71-> 0,15
CO/16-> 0,83-> 0,08
CO/32-> 0,93-> 0,03
CO/64-> 0,95-> 0,02
CO/128-> 0,98-> 0,01
CO/256-> 0,99-> 0,00
Com esses dados, faça:
Pode servir a você: ondas estacionárias: fórmulas, características, tipos, exemplosa) Um gráfico de absorvância baseado na concentração.
b) um ajuste linear dos dados e encontre a inclinação.
c) A partir da inclinação obtida, calcule a absorção molar.
Solução
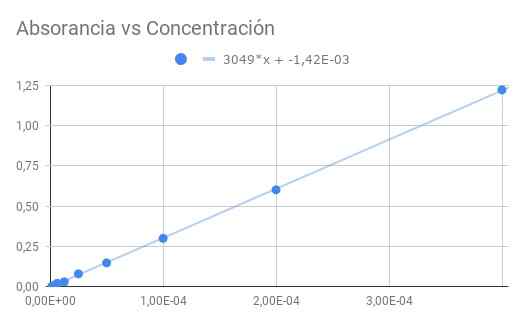 Figura 3. Absorvância versus concentração. Fonte: f. Zapata.
Figura 3. Absorvância versus concentração. Fonte: f. Zapata. A inclinação obtida é o produto da absorganividade molar pela distância óptica; portanto, dividindo a inclinação por comprimento 1,5 cm, obtemos absorção molar
ε = 3049/1,50 = 2033 (m⋅cm)^-1
Exercício 3
Com os dados do Exercício 2:
a) Calcule a absorvor de absorção para cada dados.
b) determinar um valor médio para a absorção molar, seu desvio padrão e o erro estatístico associado à média.
Solução
A absorção molar é calculada para cada uma das concentrações testadas. Lembre -se de que as condições de iluminação e a distância óptica permanecem fixas.
Os resultados da absorção molar são:
2033, 2007, 2007, 1983, 2158, 1681, 2376, 1.872, 1862 em unidades de 1/(m*cm).
A partir desses resultados, podemos assumir o valor médio:
= 1998 (m*cm)^-1
Com um desvio padrão de: 184 (m*cm)^-1
O erro médio é o desvio padrão dividido pela raiz quadrada do número de dados, ou seja::
Δ = 184/9^0,5 = 60 (m*cm)^-1
Finalmente, conclui -se que a substância patenteada tem uma absorção molar na frequência 589 nm produzida por uma lâmpada de sódio de:
= (2000 ± 60) (m*cm)^-1
Referências
- Atkins, p. 1999. Química Física. Edições Omega. 460-462.
- A guia. Transmitância e absorvância. Recuperado de: química.LaGuia2000.com
- Toxicologia Ambiental. Transmitância, absorvância e lei de Lambert. Recuperado de: repositório.Innovationumh.é
- Física de aventura. Absorvância e transmitância. Recuperado de: rpfisica.Blogspot.com
- Sistofotometria. Recuperado de: química.Librettexts.org
- Toxicologia Ambiental. Transmitância, absorvância e lei de Lambert. Recuperado de: repositório.Innovationumh.é
- Wikipedia. Absorvância. Recuperado de: Wikipedia.com
- Wikipedia. Espectrofotometria. Recuperado de: Wikipedia.com
- « Contexto, características, autores de vanguarda da América Latina -Americana
- Origens do totalitarismo, características, causas e consequências »

