Características de Treonine, funções, degradação, benefícios
- 1834
- 530
- Gilbert Franecki
O Treonina (Thr, T) ou ácido treo-α-amino-β-butírico é um dos aminoácidos constituintes de proteínas celulares. Como o homem e outros animais de vertebrados não têm rotas biossintéticas para sua produção, a Treonine é considerada um dos 9 aminoácidos essenciais que devem ser adquiridos com a dieta.
Treonine foi o último dos 20 aminoácidos comuns descobertos em proteínas, fato que ocorreu na história mais de um século após a descoberta de asparagina (1806), que foi o primeiro aminoácido descrito.
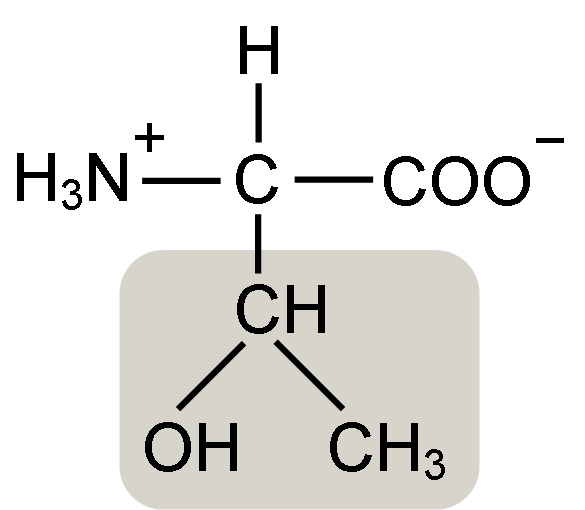
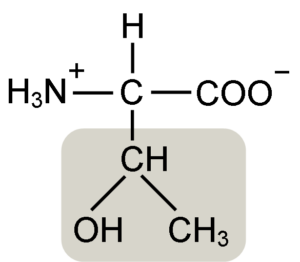 Estrutura de aminoácidos de Treonine (fonte: Keycin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Estrutura de aminoácidos de Treonine (fonte: Keycin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Foi descoberto por William Cumming Rose em 1936, que cunhou o termo "Treonine" para a similaridade estrutural que encontrou entre esse aminoácido e ácido haraônico, um composto derivado de açúcar de treose.
Como proteína de aminoácidos, a treonina possui várias funções nas células, entre as quais o local de ligação para as cadeias de carboidratos típicas das glicoproteínas e o local de reconhecimento para proteínas quinases com funções específicas (proteínas de treonina/serina quinases) se destacam).
Da mesma forma, a Treonine é um componente essencial de proteínas como esmalte dental, elastina e colágeno e também possui funções importantes no sistema nervoso. É usado como suplemento alimentar e como um "mitigador" dos estados fisiológicos da ansiedade e depressão.
[TOC]
Caracteristicas
O Treonine pertence ao grupo de aminoácidos polares que possuem um grupo de cadeia r ou lateral sem cargas positivas ou negativas (aminoácidos polares não carregados).
As características de seu grupo R são feitas por um aminoácido altamente solúvel (hidrofílico ou hidrofílico), que também é verdadeiro para os outros membros desse grupo, como cisteína, serina, asparagina e glutamina.
Juntamente com triptofano, fenilalanina, isoleucina e tirosina, a treonina é um dos cinco aminoácidos que possuem funções glicogênicas e cetogênicas, porque, por seu metabolismo, existem intermediários relevantes, como piruvato e sucinil-coa,.
Este aminoácido tem um peso molecular aproximado de 119 g/mol; Como muitos dos aminoácidos sem carga, ele tem um ponto isoelétrico em torno de 5.87 e sua frequência nas estruturas de proteínas é próxima de 6%.
Alguns autores agrupam o Treonine junto com outros aminoácidos de sabor "doce", entre os quais, por exemplo, a serina, glicina e alanina.
Estrutura
Α-aminoácidos como a treonina têm uma estrutura geral, ou seja, é comum para todos. Isso se distingue pela presença de um átomo de carbono conhecido como "α carbono", que é quiral e para o qual quatro tipos de moléculas ou substituintes diferentes são unidos.
Este carbono compartilha um de seus títulos com um átomo de hidrogênio, outro com o grupo R, que é característico para cada aminoácido, e os outros dois são ocupados pelos grupos amino (NH2) e carboxil (COOH), que são comuns para todos Os aminoácidos.
O grupo tonine r possui um grupo hidroxila que permite formar pontes de hidrogênio com outras moléculas em meios aquosos. Sua identidade pode ser definida como um grupo alcoólico (um etanol, com dois átomos de carbono), que perdeu um de seus hidrogênios para se juntar ao átomo de carbono α (-CHAH-CH3).
Este grupo -OH pode servir como um local de "ponte" ou união para uma variedade de moléculas (isso pode ser unido, por exemplo, cadeias de oligossacarídeos durante a formação de glicoproteínas), por isso é um dos responsáveis pela formação da formação de os derivados de Treonine modificados.
A forma biologicamente ativa desse aminoácido é a L-treonina e é essa que participa tanto da formação de estruturas de proteínas quanto dos vários processos metabólicos em que age.
Funções
Como proteína de aminoácidos, a treonina faz parte da estrutura de muitas proteínas na natureza, onde sua importância e riqueza dependem da identidade e função da proteína à qual pertence.
Pode atendê -lo: heterose: melhora nos animais, em plantas, ser humanoAlém de suas funções estruturais na formação da sequência peptídica de proteínas, a Treonine cumpre outras funções no sistema nervoso e no fígado, onde participa do metabolismo das gorduras e impede seu acúmulo neste órgão neste órgão.
A Treonine faz parte das seqüências reconhecidas pelas enzimas serín/Treonina quinases, responsáveis por numerosos processos de fosforilação de proteínas, essenciais para a regulação da multiplicidade de funções e eventos de sinalização intracelular.
Também é usado para o tratamento de alguns distúrbios intestinais e digestivos e sua utilidade na atenuação de condições patológicas, como ansiedade e depressão, foi demonstrada.
L-treonine, também, é um dos aminoácidos necessários para manter o estado pluripotente de células-tronco embrionárias de camundongo, um fato aparentemente relacionado ao metabolismo da S-adenosil-metionina e com os eventos de metilação das histonas, que são diretamente envolvido na expressão de genes.
Na indústria
Uma propriedade comum para muitos aminoácidos é sua capacidade de reagir com outros grupos químicos, como aldeídos ou cetonas para a formação dos "sabores" característicos de muitos compostos.
Entre esses aminoácidos está o Treonine, que, como serina, reage com sacarose durante os TOs.
A Treonine está presente em muitos medicamentos de origem natural e também em muitas formulações de suplementos nutricionais prescritos para pacientes com desnutrição ou que têm dietas ruins neste aminoácido.
Outra das funções mais notórias de L-Treonine, e que tem crescido ao longo do tempo, é aditivo na preparação de alimentos concentrados para indústrias de produção de porcos e aves.
A L-Treonine é usada nessas indústrias como um suplemento alimentar em pobres formulações do ponto de vista da proteína, uma vez que isso fornece vantagens econômicas e alivia as deficiências de proteínas brutas que esses animais de fazenda consomem.
A principal forma de produção deste aminoácido é normalmente por fermentação microbiana e números de produção mundial para fins agrícolas para o ano de 2009 excederam 75 toneladas.
Biossíntese
A Treonine é um dos nove aminoácidos essenciais para o homem, o que significa que não pode ser sintetizado pelas células do corpo e, portanto, que deve ser adquirido a partir de proteínas de origem animal ou planta que são fornecidas com a dieta diária.
Plantas, fungos e bactérias sintetizam a Treonine de rotas semelhantes que podem apresentar algumas discrepâncias. No entanto, a maioria desses organismos começa a partir de Asparto como precursor, não apenas para a Treonine, mas também para Methodin e Lysine.
Rota biossíntética em micróbios
A via de biossíntese de L-treonina em microorganismos como bactérias consiste em cinco etapas catalisadas por diferentes enzimas. O substrato de partida, como comentado, é o aspartato, que é fosforilado por uma Quinasa aspartato dependente de ATP enzimática.
Essa reação produz o fosfato metabólito L-asfato (L-aspartil-P) que serve como substrato para a enzima semiiaderidida semiiaderidia em enzima desidrogenase, que catalisa sua conversão em semi-dependente de dependente a aspartílio dependente de dependente.
O asparil semiiarida pode ser usado tanto para a biossíntese de L-lisina quanto para a biossíntese de L-treonina; Nesse caso, a molécula é usada por uma dependente dependente da enzima de homoserina para a produção de L-Homoserina.
A Lomosserina L é fosforilada em fosfato de L-homoserina (L-Homoserina-P) por uma quinase dependente de ATP homoserina e o produto de reação, por sua vez, é um substrato da enzima sintase de treonina, capaz de sintetizar L-trinina.
A L-metionina pode ser sintetizada a partir da L-Homoserina produzida na etapa anterior, por isso representa uma rota "competitiva" para a síntese de L-Treonine.
O L-treonina sintetizado dessa maneira pode ser usado para síntese de proteínas ou também pode ser usado a jusante para a síntese de glicina e L-leucina, dois aminoácidos relevantes também do ponto de vista da proteína.
Pode atendê -lo: teorias evolutivasRegulamento
É importante destacar que três das cinco enzimas que participam da biossíntese de L-treonina em bactérias são reguladas pelo produto da reação por feedback negativo. Estes são o aspartato de quinase, a homoserina desidrogenase e a homoserina quinase.
Além disso, a regulação desta rota biossintética também depende dos requisitos celulares dos outros produtos biossintéticos relacionados a ela, uma vez que a formação de L-lisina, L-metionina, L-isoleucina e glicina depende da rota de produção de produção de L-Treonine.
Degradação
Treonine pode ser degradada por duas rotas diferentes para produzir piruvato ou succinil-CoA. Este último é o produto mais importante do catabolismo de Treonine em humanos.
O metabolismo da treonina ocorre principalmente no fígado, mas o pâncreas, embora em menor grau, também participe desse processo. Esta rota começa com o transporte do aminoácido através da membrana plasmática dos hepatócitos por meio de transportadores específicos.
Produção de piruvato de Treonine
A conversão da Treonina em Piruvato ocorre graças à sua transformação em glicina, que ocorre em duas etapas catalíticas que começam com a formação de 2-amino-3-ectobutirato da treonina e pela ação da enzima treonina desidrogenase.
No ser humano, essa rota representa apenas entre 10 e 30% do catabolismo da treonina, no entanto, sua importância é relativa ao organismo que é considerado desde que, em outros mamíferos, por exemplo, isso é muito mais relevante falando catabolicamente.
Produção succinil-CoA de Treonina
Assim como a metionina, a valina e a isoleucina, os átomos de carbono da treonina também são usados para produção de succunil-CoA. Este processo começa com a conversão do aminoácido em α-cetobutirato, que é posteriormente usado como um substrato da enzima α-zo-gottoat desidrogenase para executar propionil-coa.
A transformação da treonina em α-cetobutirato é catalisada pela enzima desidratase, que implica a perda de uma molécula de água (H2O) e outro de um íon de amônio (NH4+).
Propionil-CoA é carboxilado em metilmalonil-CoA através de uma reação em duas etapas que requer a entrada de um átomo de carbono de bicarbonato (HCO3-). Este produto serve como substrato para uma dependente de metilmalonil-coa mutasa-coenzima B12, que "epimeriza" a molécula para produzir succinil-coa.
Outros produtos catabólicos
Além disso, o esqueleto de carbono da treonina pode ser usado catabolicamente para a produção de acetil-CoA, que também tem implicações importantes do ponto de vista energético nas células do corpo.
Em certos organismos, a Treonine também funciona como um substrato de algumas rotas biossintéticas, como a isoleucina, por exemplo. Nesse caso, através de 5 etapas catalíticas, α-ectobutirato derivado do catabolismo da treonina pode ser direcionado para a formação de isoleucina.
Alimentos ricos em Treonine
Embora a maioria dos alimentos abundantes na proteína tenha uma certa porcentagem de todos os aminoácidos, foi determinado que ovos, leite, soja e gelatina são especialmente ricos no aminoácido de Treonina.
Treonine também está em carnes de animais, como frango, porco, coelho, cordeiro e diferentes tipos de pássaros. Em alimentos de origem vegetal, é abundante nos chóns, na cebola, alho, acelga e berinjela.
Também é encontrado em arroz, milho, farelo de trigo, grãos de leguminosas e em muitas frutas, como morangos, bananas, uvas, abacaxi, ameixas e outras nozes ricas em proteínas, como nozes ou pistache, entre outros.
Benefícios da sua ingestão
De acordo com o Comitê de Especialistas da Organização Mundial da Saúde para Agricultura e Alimentos (OMS, FAO), a exigência diária de Treonina para um ser humano adulto médio é de cerca de 7 mg por quilograma de peso corporal, que deve ser adquirido a partir de alimentos ingeridos com dieta.
Pode atendê -lo: vermelho de fenol: características, preparação, aplicaçõesEsses números derivam de dados experimentais obtidos de estudos realizados com homens e mulheres, onde essa quantidade de treonina é suficiente para obter um equilíbrio positivo de nitrogênio nas células do corpo.
No entanto, estudos com crianças entre 6 meses e um ano de idade mostraram que, para estes, os requisitos mínimos de L-treonine estão entre 50 e 60 mg por quilograma de peso por dia.
Entre os principais benefícios da ingestão de suplementos nutricionais ou medicamentos com formulações especiais ricas em L-treonine estão o tratamento da esclerose amiotrófica lateral ou da doença de Lou Gehrig.
O suprimento adicional de Treonine favorece a absorção de nutrientes no intestino e também contribui para a melhoria das funções do fígado. Também é importante para o transporte de grupos de fosfato através das células.
Distúrbios de deficiência
Em crianças pequenas, há defeitos nascidos no metabolismo de Treonine que causam atraso no crescimento e outros distúrbios metabólicos relacionados.
As deficiências neste aminoácido têm sido associadas a algumas falhas no ganho de peso da criança, além de outras patologias relacionadas à falta de retenção de nitrogênio e sua perda na urina.
Os seres humanos submetidos a dietas pobres em Treonina podem ter uma propensão maior a sofrer de fígado gordo e algumas infecções intestinais relacionadas a este aminoácido.
Referências
- Barret, g., & Elmore, D. (2004). Aminoácidos e peptídeos. Cambridge: Cambridge University Press.
- Borgonha, s., Regan, m. M., Oh s. H., Condon, m., & Young, V. R. (2002). Requisito de treonina de adultos saudáveis, descercidos com técnica de equilíbrio de amininoácidos de 24 horas. American Journal of Clinical Nutrition, 75(4), 698-704.
- Bradford, h. (1931). A história da descoberta dos aminoácidos. Ii. Uma revisão dos aminoácidos descritos desde 1931 como componentes de proteínas nativas. Avanços na química de proteínas, 81-171.
- Champe, p., & Harvey, r. (2003). Aminoácidos aminoácidos. Em Revisões ilustradas de Lippincott: Bioquímica (3ª ed., pp. 1-12). Lippincott.
- De Lange, c. F. M., Gillis, a. M., & Simpson, G. J. (2001). Influência da ingestão de treonina na deposição de proteínas com corpo de quem e na usação de treonina em porcos em crescimento alimentados com dietas purificadas. Jornal de Ciência Animal, 79, 3087-3095.
- Edelman, a., Blumenthal, d., & Krebs, e. (1987). Proteína serina/treonina quinase. Annu. Rev., 56, 567-613.
- Edsall, J. (1960). Amininoácidos, proteínas e bioquímica de câncer (Vol. 241). Londres: Academic Press, Inc.
- Casa, j. D., Salão, b. N., & Brosnan, J. T. (2001). Metabolismo de treonina em hepatócitos isolados de ratos. American Journal of Physiology - endocrinologia e metabolismo, 281, 1300-1307.
- Hudson, b. (1992). Bioquímica de proteínas alimentares. Springer-Science+Business Media, B.V.
- Kaplan, m., & Flavin, M. (1965). Biossíntese de treonina. No caminho em fungos e bactérias e o mecanismo da reação de isomerização. O Journal of Biological Chemistry, 240(10), 3928-3933.
- Kidd, m., & Kerr, B. (mil novecentos e noventa e seis). L-THREONINE PARA POLUTRY: Uma revisão. Applied Poultry Science, Inc., 358-367.
- Pratt, e., Snyderman, s., Cheung, m., Norton, p., & Holt, e. (1954). O requisito de treonina do bebê normal. O Journal of Nutrition, 10(56), 231-251.
- Rigo, j., & Senterre, J. (1980). Ingestão de treonina ideal para infatir prematuro alimentado com nutrição oral ou parenteral. Jornal de Nutrição Parenteeral e Enterral, 4(1), 15-17.
- Shyh-chang, n., Locasale, J. C., Lyssiotis, c. PARA., Zheng, e., Teo, r. E., Ratanasirintrawoot, s.,... cantley, eu. C. (2013). Influência do metabolismo da treonina na S-adenensilmetionina e metilação da histona. Ciência, 339, 222-226.
- Vickery, h. B., & Schmidt, C. eu. PARA. (1931). A história da descoberta dos aminoácidos. Revisões químicas, 9(2), 169-318.
- Md web. (n.d.). Recuperado em 10 de setembro de 2019, de www.Webmd.com/vitaminas/ai/ingredienteno-1083/treonina
- Wormser, e. H., & Pardee, para. B. (1958). Regulação da biossíntese de treonina em Escherichia coli. Arquivos de Bioquímica e Biofísica, 78(2), 416-432.
- Xunyan, x., Quinn, p., & Xiaoyuan, x. (2012). Portão de pesquisa. Recuperado em 10 de setembro de 2019, de www.Pesquisa.net/figura/a biossíntese-pathway-of-l-thereonine-the-patway-consistida-fi-ve-enzimática-speps_fig1_232320671

