Características, tipos e seleções de funções
- 917
- 118
- Pete Wuckert
As Selectinas Eles são uma família de glicoproteínas constituídas por cadeias polipeptídicas, que reconhecem conformações específicas de açúcares (carboidratos), localizados na superfície de outras células e se ligam a eles. Por esse motivo, eles também são chamados de moléculas de adesão.
Esses receptores de adesão são conhecidos por sua estrutura preservada. Eles apresentam três domínios e três glicoproteínas diferentes. Eles podem ser expressos como moléculas de superfície, além de serem armazenados ou funcionando como moléculas solúveis.
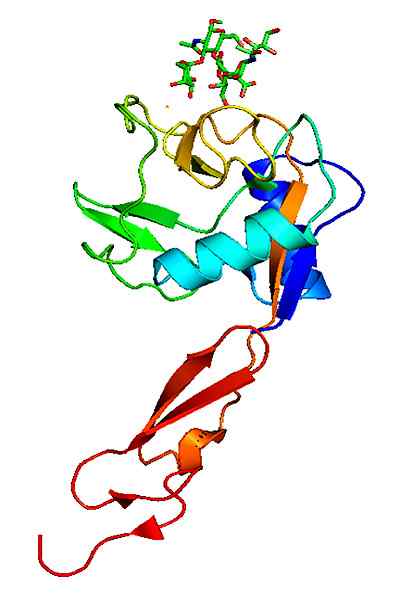
 Estrutura molecular de uma p-selectina. Tomado e editado de: Neveu, Curtis [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Estrutura molecular de uma p-selectina. Tomado e editado de: Neveu, Curtis [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Em contraste com outras moléculas de adesão, as selectinas atuam apenas nas interações dos glóbulos brancos com o endotélio vascular.
[TOC]
Caracteristicas
As selectinas são todas proteínas que contêm oligossacarídeos em cadeia, unidos por ligações covalentes a cadeias de aminoácidos laterais (glicoproteínas). São moléculas transmembranares, o que significa que eles cruzam a bicicleta lipídica.
Eles compartilham características muito semelhantes às proteínas CLEC ou Lectinas tipo C. Como, como lectinas do tipo C, as seleções requerem íons de cálcio para executar a junção.
A origem da palavra "selectina" refere -se ao fato de que essas proteínas expressam seletivamente nas células do sistema vascular e também contêm um domínio da lectina.
Alguns autores incluem selectinas (glicoproteínas) dentro das lectinas porque são moléculas que se ligam aos açúcares. No entanto, outros autores os diferenciam sob o conceito de que as lectinas reconhecem apenas carboidratos e se juntam a eles, enquanto as selectinas não apenas reconhecem e juntam açúcares, mas também são formados por carboidratos.
A regulação das seletinas ocorre no nível transcricional, através do processamento proteolítico, por classificação celular e através de expressões regulamentadas de glicosil-transferases.
As selectinas têm um domínio intracelular curto. No entanto, eles têm três domínios extracelulares, um domínio do tipo de fator de crescimento epidérmico, um domínio das unidades de lectina tipo C e repetição, semelhante às proteínas reguladoras do complemento.
Pode atendê -lo: células Hele: história, características, ciclo celular e usosPessoal
A família Selectin é composta por três tipos diferentes de glicoproteínas. Cada um deles é identificado com uma carta que denota o local onde foram identificados pela primeira vez. Em seguida, veremos cada um deles.
L-selectina
Também é conhecido como Sell, CD62L, LAM1, LEU8, LNHR, LSEL ou TQ1. É encontrado em leucócitos, daí o "L" da seleção. É um componente de superfície celular. Os três domínios são: uma contraparte das lectinas, um fator de crescimento epidérmico e duas unidades de repetição de consenso.
Apresenta vários ligantes, isto é, geralmente pequenas moléculas que se formam complexas com uma biomolécula, neste caso uma proteína. Os ligantes conhecidos para L-selectina são os seguintes.
Glicam1
Conhecida como a molécula -1 da adesão celular dependente da glicosilação, é um ligante proteoglicano que é expresso em inflamações venosas pós -capilares e permite que os linfócitos vão para a corrente sanguínea em direção aos tecidos linfóides.
CD34
É uma fosfogrototeína, detectada em vários grupos de mamíferos, como homem, ratos e ratos, entre outros. Foi descrito pela primeira vez em células -tronco hematopoiéticas. Eles são encontrados em uma variedade de células, mas está quase exclusivamente relacionada à hematopoiética.
Madcam-1
Conhecida como resina AD ou molécula de adesão celular na direção da mucosa vascular (em inglês, a molécula de adesão de células da mucosa vascular 1). É uma proteína extracelular do endotélio responsável por determinar em que o tecido os linfócitos entrarão, além de transportar açúcares para que sejam reconhecidos pela L-selectina.
PSGL-1
Conhecido entre outros sinônimos como SELPLG ou CD162, é uma glicoproteína encontrada em células endoteliais e em leucócitos. Você pode se juntar aos outros dois tipos de selectinas. No entanto, parece que ele apresenta uma melhor afinidade com P-selectina.
Pode servir a você: células fúngicas: características, organelas e funçõesP-selectina
A p-selectina é conhecida por outros nomes como SELP, CD62, CD62P, GMP140, GRMP ou LECAM3, entre outros. Está localizado na superfície das células de endotélio, que cobrem as margens internas dos vasos sanguíneos e plaquetas.
A p-selectina foi identificada pela primeira vez em plaquetas. É por isso que o nome da proteína carrega o "p" inicial.
A estrutura da p-selectina consiste em um domínio muito semelhante à lectina do tipo C na extremidade n egf; Ou seja, um domínio proteico conservado de cerca de 30 a 40 resíduos de aminoácidos, com uma folha β de dois catenários, seguida de um loop para uma folha β-terminal de curto terminal.
Apresenta uma terceira cúpula semelhante ao complemento da proteína para complementar, como o domínio Cub, que é caracterizado por ser um domínio de proteína preservado evolutivamente e apresentando cerca de 110 resíduos de aminoácidos.
O ligante com maior afinidade da P-selectina é PSGL-1, conforme descrito anteriormente nos ligantes L-Selectina. Por outro lado, essa proteína também pode formar complexos com outras moléculas, como polissacarídeo sulfatado chamado fucoidan e heparán sulfato.
E-selectina
Esta proteína da seletina também é conhecida pelos seguintes nomes: Sele, CD62E, ELAM, ELAM1, Esel, Lecam2 e outros. É expresso exclusivamente em células endoteliais que são ativadas por pequenas proteínas que não são capazes de atravessar a bicamada lipídica da célula, chamada citocinas.
A estrutura desta proteína consiste em 3 domínios (como o restante das seletinas): um domínio semelhante ao EGF, 6 unidades de módulos de proteína de controle (também chamados domínios de sushi) de REPT SCR e um domínio transmembranar.
Pode atendê -lo: megacariócitos: características, estrutura, formação, maturação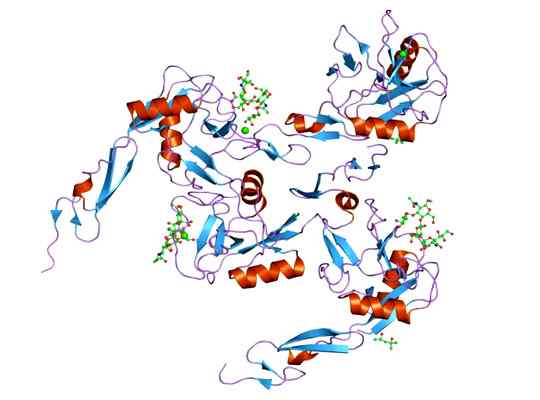 Representação da estrutura molecular da proteína E-selectina, cujo dominó é EGF. Tomado e editado de: Jawahar Swaminathan e funcionários do MSD no European Bioinformatics Institute [Public Domain].
Representação da estrutura molecular da proteína E-selectina, cujo dominó é EGF. Tomado e editado de: Jawahar Swaminathan e funcionários do MSD no European Bioinformatics Institute [Public Domain]. O ligante que forma complexos com o e-seletivo é bastante variado, mas aqueles que se destacam são os seguintes.
SILYL-LEWIS A
Também chamado SLe A CA19-9. É um tetrasacarídeo em soros de pacientes com câncer. É conhecido por participar do processo de reconhecimento de células-células. É expresso constitutivamente em granulócitos, monócitos e linfócitos t.
SILYL-LEWIS X
É também um tetrataSacarídeo como Sialil-Lewis A e tem funções semelhantes. É expresso em granulócitos e monócitos e controla a saída ou vazamento indesejados dessas células durante a inflamação.
PSGL-1
Embora seja aparentemente mais eficiente na p-selectina, alguns autores consideram que a forma derivada do neutrófilo humana também é bastante eficiente na e-selectina. De fato, eles consideram que, em geral, esse ligante é fundamental para os três tipos de selectinas.
Função
A principal função das seletinas é fazer parte do processo de formação de glóbulos brancos (linfócitos). Eles também participam da resposta imune, em inflamações crônicas e agudas em diferentes órgãos do corpo, como rins, coração e pele. Eles até agem nos processos inflamatórios de metástases carcinogênicas.
Referências
- Selectin. Recuperado de: em.Wikipedia.org.
- L-selectina. Recuperado de: em.Wikipedia.org.
- CA19-9. Recuperado de: em.Wikipedia.org.
- E-selectina. Recuperado de: em.Wikipedia.org.
- X. Zou, v.R. Shinde Patil, n.M. Dagia, l.PARA. Smith, m.J. Wargo, k.PARA. Interliggi, c.M. Lloyd, d.F. Tees, b. Walcheck, m.B. Lawrence, d.J. Goetz (2005). PSGL-1 deriado dos neutrófilos humanos é um ligante de alta eficiência para Edothelium-Expresse e-selectina sob fluxo. American Journal of Physiology. Fisiologia celular.
- K. Law (2001). Funções das selectinas. Resultados e problemas na diferenciação celular.
- Selectinas. Recuperado de: WellPath.Uniovi.é.
- J.H. Pérez & C.J. Montoya. Moléculas de adesão. Recuperado de: Encolombia.com.
- PARA.C. Sanguineti & J.M Rodríguez-Tafur (1999). Adesão e moléculas da pele. Dermatologia peruana.
- T.F. Tedder, d.PARA. Steeber, a. Chen, p. Engel (1995). As Selectinas: Moléculas de Adesão Vascular. FASEB Journal.
- « Recursos de mangue brancos, habitat, taxonomia, usos
- Características, estrutura e funções integrinas »

