Características de miofibrilas, estrutura, composição, funções
- 2938
- 61
- Alfred Kub
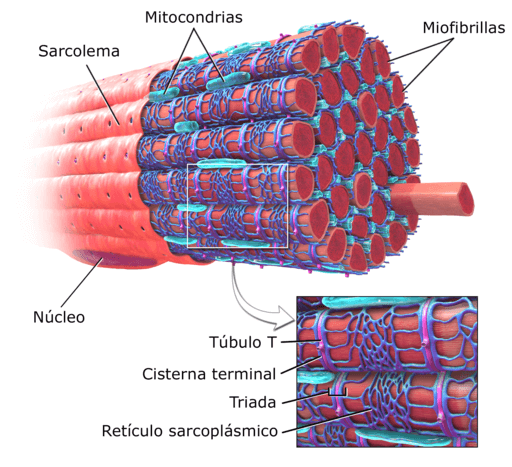
As Miofibrilas São as unidades estruturais das células musculares, também conhecidas como fibras musculares. Eles são muito abundantes, são fixados em paralelo e são incorporados pelo citosol dessas células.
As células ou fibras musculares fortes são células muito longas, sendo capazes de medir até 15 cm de comprimento e de 10 a 100 μm de diâmetro. Sua membrana plasmática é conhecida como sarcolema e seu citosol como sarcoplasma.
 Diagrama da estrutura muscular de um ser humano (fonte: deglr6328 ~ commonswiki, via Wikimedia Commons)
Diagrama da estrutura muscular de um ser humano (fonte: deglr6328 ~ commonswiki, via Wikimedia Commons) Dentro dessas células estão, além das miofibrilas, vários núcleos e mitocôndrias que são conhecidas como sarcosomos, bem como um retículo endoplasmático proeminente conhecido como retículo sarcoplasmático.
As miofibrilas são reconhecidas como os "elementos contráteis" dos músculos em animais de vertebrados. Eles são compostos de vários tipos de proteínas que são as que lhes dão as características elásticas e retráteis. Além disso, eles ocupam uma parte importante do sarcoplasma das fibras musculares.
[TOC]
Diferenças entre fibras musculares
Existem dois tipos de fibras musculares: fibras estriadas e lisas, cada uma com uma distribuição anatômica e uma função específica. As miofibrilas são especialmente importantes e evidentes nas fibras musculares estriadas que compõem o músculo esquelético.
As fibras estriadas têm um padrão repetitivo de bandas transversais quando são observadas em um microscópio e estão associadas a músculos esqueléticos e parte da musculatura cardíaca.
As fibras lisas, pelo contrário, não apresentam o mesmo padrão sob o microscópio e são encontradas nos músculos característicos da vasculatura e do sistema digestivo (e todas as vísceras).
Características gerais
As miofibrilas são compostas por dois tipos de filamentos contráteis (também conhecidos como miofilamentos), que por sua vez são compostos de miosina e proteínas filamentosas de miosina, que serão descritas posteriormente.
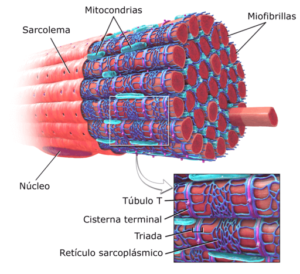 Representação gráfica de miofibrilas no músculo esquelético (fonte: Brublaus modificado [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Representação gráfica de miofibrilas no músculo esquelético (fonte: Brublaus modificado [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Diferentes pesquisadores determinaram que a vida média das proteínas contráteis das miofibrilas passa de 5 dias a 2 semanas; portanto, o músculo é um tecido altamente dinâmico, não apenas do ponto de vista contrátil, mas da síntese e renovação de seus elementos estruturais.
A unidade funcional de cada miofibrilha em células musculares ou fibras é chamada sarcomcomro e é delimitada por uma região conhecida como "banda ou linha z", de onde os miofilamentos da actina são estendidos em paralelo.
Como as miofibrilas ocupam parte substancial do sarcoplasma, essas estruturas fibrosas restringem a localização dos centros das células às quais pertencem à periferia da mesma, perto do sarcolema.
Pode servir a você: célula humana: características, funções, peças (organelas)Algumas patologias humanas estão relacionadas ao deslocamento dos núcleos em vigas miofibrilares, e estas são conhecidas como miopatias centrais-nucleares.
Formação de miofibrilas ou "miofibrilogênese"
Os primeiros miofils são montados durante o desenvolvimento do músculo esquelético embrionário.
As proteínas que compõem os sarcomers (as unidades funcionais das miofibrilas) estão inicialmente alinhadas das extremidades e lados de um "prêmio" composto por filamentos de actina e pequenas porções de miosina II não-muscular e específico do ato específico do músculo.
À medida que isso ocorre, nas fibras musculares que eles expressam, em diferentes proporções, os genes codificadores para as isoformas cardíacas e esqueléticas da α-actina. Primeiro, a quantidade de isoforma cardíaca expressa é maior e, em seguida, isso muda para o esquelético.
Após a formação do prêmio, as miofibrilas nascentes são montadas atrás da zona de formação de prêmios e nessas formas de miosina II muscular é detectada.
Neste ponto, os filamentos de miosina estão alinhados e complexos com outras proteínas específicas da união da miosina, que também ocorre com os filamentos de actina.
Estrutura e composição
Como mencionado há um momento, as miofibrilas são compostas por miofilamentos de proteínas contráteis: actina e miosina, que também são conhecidas como miofilamentos finos e espessos, respectivamente. Estes são visíveis para o microscópio óptico.
- Miofilamentos finos
Os finos filamentos das miofibrilas são compostos de proteína de actina em sua forma filamentada (actina F), que é um polímero na forma globular (actina G), que tem um tamanho menor.
Os fios filamentosos da actina G (actina F) formam um fio duplo que é embrulhado em forma de hélice. Cada monômero destes pesa mais ou menos 40 kDa e é capaz de se juntar à miosina em lugares específicos.
Esses filamentos têm cerca de 7 nm de diâmetro e se estendem entre duas áreas conhecidas como a banda I e a banda a. Na banda A, esses filamentos estão localizados em torno dos grossos filamentos que formam um arranjo hexagonal secundário.
Especificamente, cada filamento fino é simetricamente separado de três filamentos grossos, e cada filamento grosso é cercado por seis filamentos finos.
Filamentos finos e grossos interagem entre si através de "pontes cruzadas" que se destacam dos filamentos grossos e que aparecem na estrutura da miofibrilha em intervalos regulares de distâncias próximas a 14 nm.
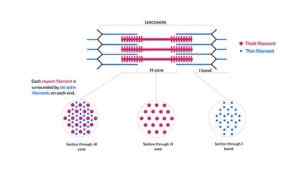 Representação esquemática de miofilamentos que compõem miofibrilas e seus cortes (fonte: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Representação esquemática de miofilamentos que compõem miofibrilas e seus cortes (fonte: Kamran Maqsood 93 [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Os filamentos de actina e outras proteínas associadas estendem -se projetando -se das "bordas" das linhas z e se sobrepõem aos filamentos de miosina em direção ao centro de cada sarcômero.
Pode atendê -lo: Nutrição celular: processo e nutrientes- Miofilamentos grossos
Filamentos espessos são polímeros da proteína miosina II (510 kDa cada) e são delimitados pelas regiões conhecidas como "Bandas A".
Os miofilamentos da miosina têm aproximadamente 16 nm de comprimento e são distribuídos em arranjos hexagonais (se for observada uma seção transversal de uma miofibrilla).
Cada filamentos de miosina II é composto de muitas moléculas de miosina compactadas, cada uma das quais consiste em duas cadeias polipeptídicas que têm uma região ou "cabeça" na forma de um maza e que acomodam "cachos" para formar os filamentos.
Ambos os pacotes são sustentados através de suas extremidades no centro de cada sarcômero, para que as "cabeças" de cada miosina sejam direcionadas para a linha Z, onde os filamentos finos são fixos.
As cabeças de miosina cumprem funções muito importantes, uma vez que têm locais de união para moléculas de ATP e, além disso, durante a contração muscular, são capazes de formar as pontes cruzadas para interagir com os filamentos finos da actina.
- Proteínas associadas
Os filamentos de actina estão "ancorados" ou "fixos" à membrana plasmática das fibras musculares (sarcolema) graças à sua interação com outra proteína conhecida como distrofina.
Além disso, existem duas importantes proteínas da união de actina conhecidas como troponina e tropomiosina que, juntamente com os filamentos de actina, formam um complexo de proteínas. Ambas as proteínas são essenciais para a regulação de interações que ocorrem entre filamentos finos e grossos.
A tropomiosina também é uma molécula filamentária de dois textos que está associada à actina propensa especificamente na região da ranhura que ocorrem entre os dois fios. A troponina é um complexo de proteínas globulares tripartidas que está disponível em intervalos sobre filamentos de actina.
Este último complexo funciona como um "interruptor" dependente de cálcio que regula os processos de contração das fibras musculares, por isso é da maior importância.
No músculo estriado dos animais de vertebrados, além de duas outras proteínas que interagem com os filamentos grossos e finos, conhecidos como Titina e Nebulina, respectivamente.
A nebulina tem funções importantes na regulamentação da duração dos filamentos de actina, enquanto o título participa do apoio e da ancoragem dos filamentos de miosina em uma região do sarcomo conhecido como linha M.
Outras proteínas
Existem outras proteínas associadas a miofilamentos espessos que são conhecidos como a proteína C da união da miosina e miomesina, responsáveis por consertar filamentos de miosina na linha M.
Pode atendê -lo: Unaport: transporte através de membranas, característicasFunções
As miofibrilas têm implicações elementares na capacidade de mover animais de vertebrados.
Como são constituídos por complexos de proteínas fibrosas e contráteis do aparelho muscular, são essenciais para executar respostas aos estímulos nervosos que levam ao movimento e deslocamento (nos músculos estriados esqueléticos).
As propriedades dinâmicas indiscutíveis do músculo esquelético, que incluem mais de 40% do peso corporal, são conferidas pelas miofibrilas que, ao mesmo tempo, têm 70% das proteínas do corpo humano entre 50 e 70%.
As miofibrilas, como parte desses músculos, participam de todas as suas funções:
- Mecânica: Converter energia química em energia mecânica para gerar força, manter a postura, produzir movimentos, etc.
- Metabólico: Como o músculo participa do metabolismo da energia basal e serve como um local de armazenamento de substâncias fundamentais, como aminoácidos e carboidratos; Também contribui para a produção de calor e consumo de energia e oxigênio usado durante atividades físicas ou exercícios esportivos.
Como as miofibrilas são compostas principalmente de proteínas, elas representam um local de armazenamento e liberação de aminoácidos que contribuem para a manutenção de níveis sanguíneos de glicose durante o jejum ou a fome.
Além disso, a libertação dos aminoácidos dessas estruturas musculares tem transcendência do ponto de vista das necessidades biossintéticas de outros tecidos, como pele, cérebro, coração e outros órgãos.
Referências
- Desoulos, a., & Silbernagl, S. (2003). Atlas da cor da fisiologia (5ª ed.). Nova York: Thieme.
- Friedman, a. eu., & Goldman, e. E. (mil novecentos e noventa e seis). Caracterização mecânica de miofibrilas musculares esqueléticas. Jornal Biophysical, 71(5), 2774-2785.
- Borda, w. R., & Ochala, J. (2014). Músculo esquelético: uma breve revisão da estrutura e função. Calcif Tissue Int, Quatro cinco(2), 183-195.
- Goldspink, g. (1970). A proliferação de miofibrilas durante o crescimento da fibra muscular. J. Célula sct., 6, 593-603.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Bioquímica ilustrada de Harper (28ª ed.). McGraw-Hill Medical.
- Rosen, J. N., & Baylies, M. K. (2017). Miofibrilas colocam o aperto nos núcleos. Biologia da Cells Nature, 19(10).
- Sanger, j., Wangs, j., Fã, e., White, J., Mi-meu, l., Dube, d.,... Pruyne, D. (2016). Montagem e manutenção de miofibrilas no músculo estriado. Em Manual de Farmacologia Experimental (p. 37). Nova York, EUA: Springer International Publishing Suíça.
- Sanger, j. C., Wang, J., Fã, e., White, J., & Sanger, J. M. (2010). Montagem e dinâmica das miofibrilas. Jornal de Biomedicina e Biotecnologia, 2010, 8.
- Sobieszek, a., & Bremel, R. (1975). Preparação e propriedades de vertebrados lisos - miofibrilas musculares e actomiosina. Jornal Europeu de Bioquímica, 55(1), 49-60.
- Villee, c., Walker, w., & Smith, f. (1963). Zoologia geral (2ª ed.). Londres: w. B. Saunders Company.
- « Características de lobelia, habitat, distribuição, espécie
- Características cefalópodes, habitat, reprodução, nutrição »

