Características, estrutura, funções, patologia dos microfilamentos
- 1293
- 24
- Conrad Schmidt
O microfilamentos o Filamentos de actina, são um dos três componentes fundamentais da citoeskeleta de células eucarióticas.
Nos eucariotos, os genes que codificam os microfilamentos de actina são altamente preservados em todos os organismos, por isso são frequentemente usados como marcadores moleculares para vários estudos.
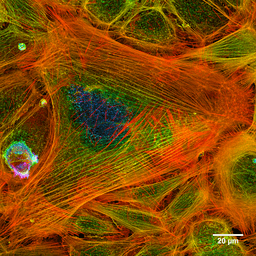
 Fotografia dos filamentos de actina de uma célula tingida (fonte: Howard Vindin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons)
Fotografia dos filamentos de actina de uma célula tingida (fonte: Howard Vindin [CC BY-SA 4.0 (https: // CreativeCommons.Org/licenças/BY-SA/4.0)] via Wikimedia Commons) Os microfilamentos são distribuídos por todo o citosol, mas são especialmente abundantes na região subjacente à membrana plasmática, onde formam uma rede complexa e estão associados a outras proteínas especiais para formar o citoesqueleto.
As redes de microfilamentos no citoplasma das células de mamíferos são codificadas por dois dos seis genes descritos para a actina, que estão envolvidos na dinâmica dos microfilamentos e que são muito importantes durante a diferenciação das células -tronco.
Muitos autores concordam que os microfilamentos são as proteínas mais diversas, versáteis e importantes do citoesqueleto da maioria das células eucarióticas, e é importante lembrar que estes não são encontrados em microorganismos procarióticos.
Nesse tipo de células, no entanto, existem filamentos homólogos para microfilamentos, mas que são formados por outra proteína: proteína Mreb.
Atualmente, pensa -se que o gene que codifica para esta proteína é um possível gene ancestral para a actina eucariótica. No entanto, a homologia de sequência de aminoácidos que forma a proteína MREB é de apenas 15% em relação à sequência de actina.
Como são uma parte fundamental do citoesqueleto, qualquer defeito fenotípico em microtúbulos e em filamentos intermediários e microfilamentos de actina (citoesqueleto) pode causar diferentes células e patologias sistêmicas.
[TOC]
Características e estrutura
Os microfilamentos são compostos de monômeros de proteína da família da actina, que são proteínas contráteis extremamente abundantes em células eucarióticas, pois também participam da contração muscular.
Esses filamentos têm um diâmetro entre 5 e 7 nm, portanto também são conhecidos como filamentos finos e são compostos por duas formas de actina: a forma globular (actina G) e a forma filamentosa (actina F).
As proteínas que participam do citoesqueleto são conhecidas como actinas γ e β, enquanto os participantes da contração são geralmente actinas α.
Pode atendê -lo: citoplasma: funções, peças e característicasA proporção de actina globular e actina filamentosa no citosol depende das necessidades celulares, uma vez que os microfilamentos são estruturas muito variáveis e versáteis, que são constantemente crescimento e encurtamento devido à polimerização e despolimeterização.
A actina G é uma pequena proteína globular, composta por quase 400 aminoácidos e cerca de 43 kDa de peso molecular.
Os monômeros de actina G que compõem os microfilamentos são ordenados na forma de uma fita helicoidal, uma vez que cada um sofre uma torção quando associado ao seguinte.
A actina G está associada a uma molécula de Ca2+ e outro ATP, que estabiliza sua forma globular; Enquanto a actina F é obtida após a hidrólise do fosfato terminal da molécula ATP na actina G, que contribui para a polimerização.
Organização
Os filamentos de actina podem ser organizados na forma de "vigas" ou "redes" que têm funções diferentes dentro das células. As vigas formam estruturas paralelas ligadas por pontes cruzadas bastante rígidas.
As redes, por outro lado, são estruturas mais confortáveis, como malhas tridimensionais com as propriedades dos géis semi -sólidos.
Existem muitas proteínas associadas a filamentos de actina ou microfilamentos e que são conhecidos como ABP (do inglês Proteínas de ligação à actina), que têm sites específicos para isso.
Muitas dessas proteínas permitem que os microfilamentos interajam com os outros dois componentes do citoesqueleto: microtúbulos e filamentos intermediários, bem como com os outros componentes da face interna da membrana plasmática.
Entre outras proteínas que interagem com os microfilamentos estão folhas nucleares e espectrina (em glóbulos vermelhos).
Como os filamentos de actina são formados?
Como os monômeros globulares de actina sempre se juntam da mesma maneira, orientados na mesma direção, os microfilamentos têm uma polaridade definida, com dois extremos: um "mais" e um "menos".
A polaridade desses filamentos é muito importante, pois eles crescem consideravelmente mais rápidos por causa de seu fim positivo, onde os novos monômeros de actina G são adicionados.
 Representação gráfica dos microfilamentos de actina (Fonte: Trabalho derivado: Retama (Talk) Thin_Filament_Formation.SVG: Mikael Häggström [domínio público] via Wikimedia Commons)
Representação gráfica dos microfilamentos de actina (Fonte: Trabalho derivado: Retama (Talk) Thin_Filament_Formation.SVG: Mikael Häggström [domínio público] via Wikimedia Commons) A primeira coisa que ocorre durante a polimerização dos filamentos de actina é um processo conhecido como "nucleação", que consiste na associação de três monômeros de proteína.
Pode atendê -lo: PlasomóliseA esse aparador, novos monômeros são adicionados pelas duas extremidades, para que o filamento cresça. Os monômeros de actina são capazes de hidrolyz ATP com cada união, o que tem implicações na velocidade da polimerização, uma vez que as porções actina-ATP se dissociam mais dificuldade do que a actina-adp.
O ATP não é necessário para a polimerização e a função concreta de sua hidrólise ainda não foi esclarecida.
Alguns autores consideram que, uma vez que os eventos de polimerização de actina são rápidos.
Regulamento
Tanto a polimerização dos filamentos de actina quanto sua despolimerização são processos altamente regulados por uma série de proteínas específicas, responsáveis pela remodelação dos filamentos dos filamentos.
Exemplo das proteínas que regulam os depolímeros. Outra proteína, a profilina, tem uma função oposta, pois estimula a associação de monômeros (estimulando a troca do ADP pelo ATP).
Funções
Os microfilamentos interagem com os filamentos de miosina associados a proteínas transmembranares que possuem um domínio no citosol e outra célula no exterior, para que participem de processos de mobilidade celular.
Esses microfilamentos associados à membrana plasmática mediam diferentes respostas celulares a diferentes tipos de estímulos. Por exemplo, a adesão celular dos tecidos epiteliais é direcionada por proteínas transmembranares conhecidas como caderinas, que interagem com microfilamentos para recrutar fatores de resposta.
Os filamentos de actina interagem com os filamentos intermediários para que estímulos extracelulares transmitam para locais -chave, como ribossomos e cromossomos dentro do núcleo.
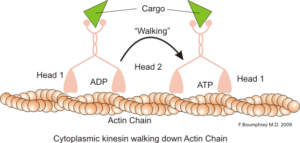 Representação da função motora intracelular dos microfilamentos de actina (Fonte: Boumphreyfr [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Representação da função motora intracelular dos microfilamentos de actina (Fonte: Boumphreyfr [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Uma função clássica e muito estudada dos microfilamentos é sua capacidade de formar "pontes", "trilhos" ou "rodovias" para o movimento da proteína Motor Mioosina I, que é capaz de carregar vesículas de transporte das organelas para o plasma de membrana no Secretário Caminhos.
Os microfilamentos também interagem com a miosina II para estabelecer o anel contrátil formado durante a citocinese, precisamente durante a última etapa da divisão celular em que o citosol é separado das células -tronco e filha.
Pode atendê -lo: leucócitos polimorfonuclearesEm geral, os microfilamentos em forma de actina modulam a distribuição de algumas organelas, como o complexo Golgi, o retículo endoplasmático e as mitocôndrias. Além disso, eles também participam do posicionamento espacial dos RNMs para que sejam lidos pelos ribossomos.
Todo o conjunto de microfilamentos de telefone celular, especialmente aqueles que estão intimamente relacionados à membrana plasmática, participam da formação de membranas celulares onduladas de células que possuem um movimento ativo constante.
Eles também participam da formação de microvings e outras protuberâncias comuns na superfície de muitas células.
Exemplo de funções no fígado
Os microfilamentos participam do processo de secreção biliar em hepatócitos (células hepáticas) e também em movimentos peristálticos (contração coordenada) de canaliculi do fígado.
Eles contribuem para a diferenciação dos domínios da membrana plasmática, graças à sua associação com diferentes elementos citosólicos e ao controle que eles exercem sobre a topografia desses elementos intracelulares.
Patologias relacionadas
Existem poucas doenças associadas a defeitos primários na estrutura ou a proteínas e enzimas regulatórias na síntese de microfilamentos, embora estes estejam diretamente envolvidos em um grande número de funções.
O baixo índice de doenças e malformações na estrutura primária dos microfilamentos se deve ao fato de que geralmente existem múltiplos genes de codificação de actina e suas proteínas reguladoras, um fenômeno conhecido como "redundância genética".
Uma das patologias mais estudadas é a vitrificação de oócitos em seu citoesqueleto, onde uma interrupção é observada na rede de microfilamentos corticais, bem como uma despolimerização e uma desorganização dos microtúbulos da espinha mitótica.
Em termos gerais, essa vitrificação causa dispersão cromossômica, pois leva a um desacordo na compactação de toda a cromatina.
As células que têm uma organização e proporção de microfilamentos maiores em seu citoesqueleto são células musculares estriadas; portanto, a maioria das patologias está associada a um mau funcionamento do aparelho contrátil.
Microfilamentos defeituosos ou atípicos também foram associados à doença óssea conhecida como doença de Paget.
Referências
- Aguilar-Cuenca, R., Llorente-González, c., Vicente, c., & Vicente-Manzanares, M. (2017). A dinâmica de adesão coordenada por microfilamentos aciona a migração de células únicas e molda os tecidos de quem. F1000Resarch, 6.
- Dois remédios, C. G., Chhabra, d., Kekic, m., Dedo, i. V., Tsubakihara, m., Berry, d. PARA., & Nosworthy, n. J. (2003). Proteínas de ligação actina: regulação de microfilamentos citoesqueléticos. Revisões fisiológicas, 83(2), 433-473.
- Guo, h., Fauci, l., Shelley, m., & Kanso, e. (2018). Bistabilidade na sincronização de microfilamentos acionados. Journal of Fluid Mechanics, 836, 304-323.
- Lançar., Langer, r., & Vago, j. P. (Eds.). (2011). Princípios de engenharia de tecidos. Academic Press.
- Robbins, j. (2017). Doenças do citoesqueleto: as desminopatias. Em miopatias cardiosqueléticas em crianças e adultos (pp. 173-192). Academic Press.
- « Características do urso pardo, habitat, comida, comportamento
- Características de Cistus clusii, taxonomia, habitat, distribuição, usos »

