Características, funções e exemplos holoenzimas
- 3888
- 1198
- Alfred Kub
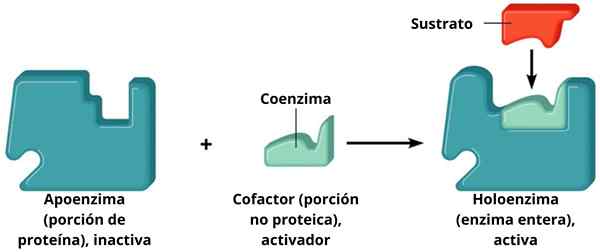
A Holoenzima É uma enzima formada por uma parte da proteína chamada apoenzima combinada com uma molécula não -proteína chamada cofactor. Nem o apoiador nem o cofator estão ativos quando estão separadamente; isto é, para funcionar, eles precisam ser acoplados.
Assim, holoenzimas são enzimas combinadas e, consequentemente, são catalisadoras ativas. As enzimas são um tipo de biomoléculas cuja função está basicamente aumentando a velocidade das reações celulares. Algumas enzimas precisam da ajuda de outras moléculas, chamadas de cofatores.
 Suporte + cofator = holoenzima
Suporte + cofator = holoenzima Os cofatores se complementam com os suportes e formam uma holoenzima ativa que executa a catálise. Essas enzimas que requerem um cofator específico são conhecidas como enzimas conjugadas. Eles têm dois componentes principais: o cofator, que pode ser um íon metálico (inorgânico) ou uma molécula orgânica; A apoenzima, parte da proteína.
[TOC]
Características de holoenzimas
Formado por apoiadores e cofatores
Apoia é a parte da proteína do complexo, e os cofatores podem ser íons ou moléculas orgânicas.
Admita variedade de cofatores
Existem vários tipos de cofatores que ajudam a formar holoenzimas. Alguns exemplos são coenzimas e vitaminas comuns, por exemplo: vitamina B, FAD, NAD+, vitamina C t coenzima A.
Alguns cofatores com íons metálicos, por exemplo: cobre, ferro, zinco, cálcio e magnésio, entre outros. Outro tipo de cofatores são os grupos protéticos tão chamados.
União temporal ou permanente
Os cofatores podem unir suporte com intensidade diferente. Em alguns casos, a união é fraca e temporária, enquanto, em outros casos, a união é tão forte que é permanente.
Nos casos em que a união é temporária, quando o cofator é eliminado da holoenzima, torna -se apoio novamente e deixando de ser ativo.
Função
A holoenzima é uma enzima pronta para exercer sua função catalítica; isto é, acelerar certas reações químicas que são geradas em diferentes áreas.
As funções podem variar de acordo com a ação específica da holoenzima. Entre os mais importantes estandes da polimerase de DNA, cuja função é garantir que a cópia do DNA seja feita corretamente.
Pode servir a você: Ardipithecus: Descoberta, características, crânioExemplos de holoenzimas comuns
RNA polimerase
 RNA da polimerase 3D. Fonte: Maria Voigt., CC por 4.0, via Wikimedia Commons
RNA da polimerase 3D. Fonte: Maria Voigt., CC por 4.0, via Wikimedia Commons A RNA polimerase é uma holoenzima que catalisa a reação da síntese de RNA. Esta holoenzima é necessária para construir cadeias de RNA a partir de cadeias de molde de DNA que funcionam como modelos durante o processo de transcrição.
Sua função é adicionar ribonucleotídeos no final 3 de uma molécula de RNA em crescimento. Nos procariontes, o suporte à RNA polimerase precisa de um cofator chamado Sigma 70.
Polimerase de DNA
 HOMIENS HOMO SAPIENS BETA Beta DNA Estrutura. Fonte: Yikrazuul, CC BY-SA 3.0, via Wikimedia Commons
HOMIENS HOMO SAPIENS BETA Beta DNA Estrutura. Fonte: Yikrazuul, CC BY-SA 3.0, via Wikimedia Commons A polimerase de DNA também é uma holoenzima que catalisa a reação de polimerização de DNA. Essa enzima cumpre uma função muito importante para as células porque é responsável por replicar informações genéticas.
A polimerase de DNA precisa de um íon com carga positiva, normalmente magnésio, para poder desempenhar sua função.
Existem vários tipos de polimerase de DNA: a DNA polimerase III é uma holoenzima que possui duas enzimas centrais (Pol III), cada composto de três subunidades (α, ɛ e θ), um grampo deslizante que possui duas subunidades beta e um complexo de carga Configuração que possui várias subunidades (Δ, τ, γ, ψ e χ).
Anidrase carbônica
 Estrutura de anidrase carbônica
Estrutura de anidrase carbônica A anidrase carbônica, também chamada de desidratação de carbonato, pertence a uma família de holoenzimas que catalisam a rápida conversão de dióxido de carbono (CO₂) e água (H20) em bicarbonato (H2CO3) e prótons (H+).
A enzima requer um íon de zinco (Zn+2) como um cofator para executar sua função. A reação catalisada por anidrase carbônica é reversível, por esse motivo, sua atividade é considerada importante, pois ajuda a manter o equilíbrio ácido-base entre sangue e tecidos.
Hemoglobina
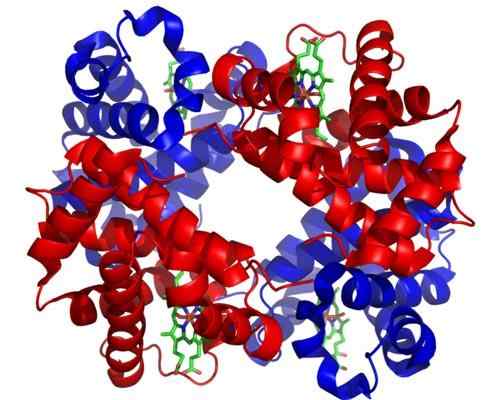 Hemoglobina
Hemoglobina A hemoglobina é uma holoenzima muito importante para o transporte de gás em tecidos animais. Esta proteína presente nos glóbulos vermelhos contém ferro (Fe+2), e sua função é transportar oxigênio dos pulmões para outras áreas do corpo.
Pode atendê -lo: organismos fotossintéticosA estrutura molecular da hemoglobina é um tetrâmero, o que significa que é composto por 4 cadeias ou subunidades polipeptídicas.
Cada subunidade desta holoenzima contém um grupo Hemo, e cada grupo Hemo contém um átomo de ferro que pode unir moléculas de oxigênio. O grupo Hemo Hemo é seu grupo protético, necessário para sua função catalítica.
Citocromo oxidase
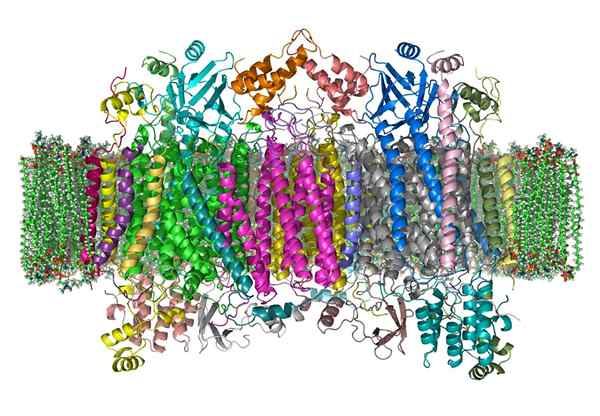 Citocromo oxidase
Citocromo oxidase O citocromo oxidase é uma enzima que participa dos processos de obtenção de energia, que são realizados nas mitocôndrias de quase todos os seres vivos.
É uma holoenzima complexa que requer a colaboração de certos cofatores, íons de ferro e cobre, a fim de catalisar a reação de transferência de elétrons e a produção de ATP.
Piruvato quinase
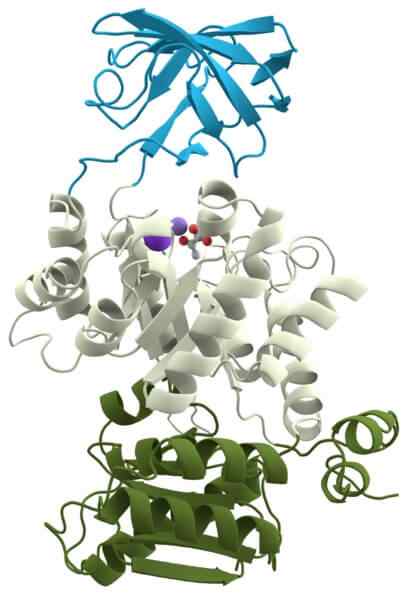 Citocromo oxidase
Citocromo oxidase O piruvato de quinase é outra holoenzima importante para todas as células, porque participa de uma das rotas metabólicas universais: glicólise.
Sua função é catalisar a transferência de um grupo fosfato de uma molécula chamada fosfoenolpiruvato para outra molécula chamada difosfato adenosina, para formar ATP e piruvato.
O suporte requer cátions de potássio (k ') e magnésio (mg+2) como cofatores para formar holoenzima funcional.
Piruvato de carboxilase
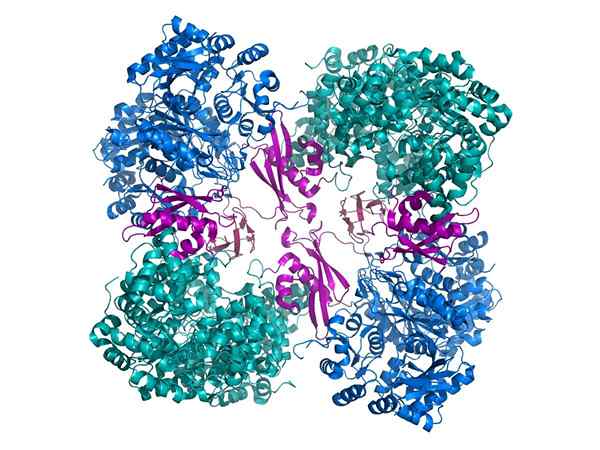 Piruvato de carboxilase
Piruvato de carboxilase Outro exemplo importante é o piruvato de carboxilase, um holoenzy. Assim, o piruvato se torna oxalacetato, um importante intermediário no metabolismo.
Para ser funcionalmente ativo, o piravato foose -carboxilase requer um cofator chamado biotina.
Acetil coA carboxilase
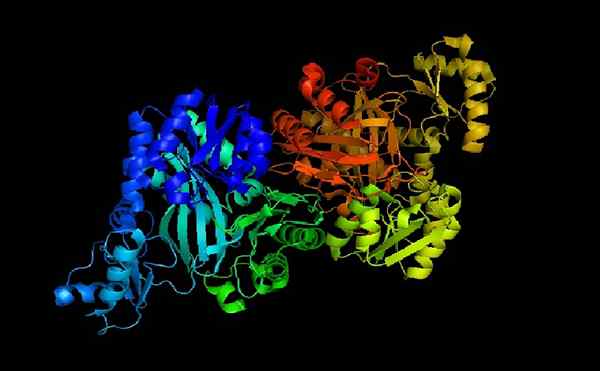 Acetil coa carboxilase e-coli
Acetil coa carboxilase e-coli Acetil-coa carboxilase é uma holoenzima cujo cofator, como indicado por seu nome, é a coenzima para.
Quando a apoenzima e a coenzima A são acopladas, a holoenzima é cataliticamente ativa para desempenhar sua função: transfira um grupo carboxil para acetil-coa para transformá-lo em coenzima malonil A (malonil-coa).
Pode atendê -lo: cacho: composição, peças, importânciaO acetil-CoA desempenha funções importantes em células animais e células vegetais.
Oxidase monoamina
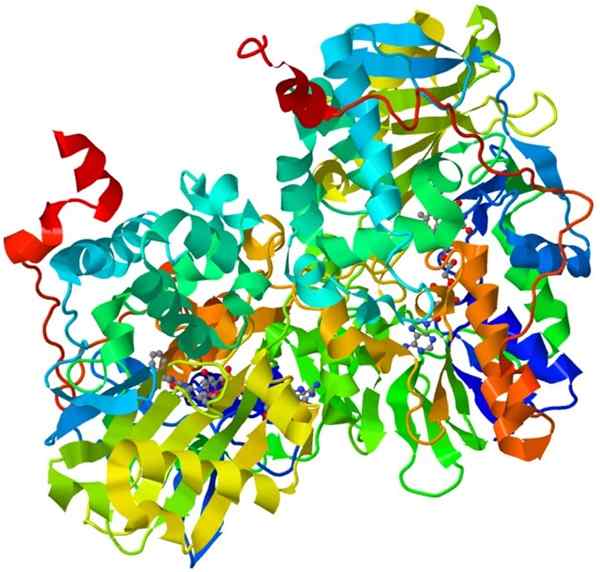 Estrutura de monoamina oxidase
Estrutura de monoamina oxidase Esta é uma holoenzima importante no sistema nervoso humano, sua função é promover a degradação de certos neurotransmissores.
Para que a monoamina da oxidase seja cataliticamente ativa, ela precisa unir covalentemente seu cofator, o flavina e a adenina dinucleotídeo (FAD).
Lactato desidrogenase
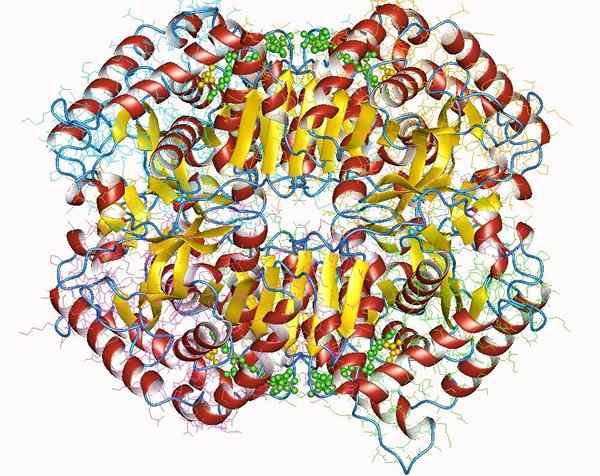 Lactato desidrogenase
Lactato desidrogenase A lactato desidrogenase é uma holoenzima importante para todos os seres vivos, particularmente em tecidos que consomem muita energia, como coração, cérebro, fígado, músculo esquelético, pulmões, entre outros.
Esta enzima requer a presença de seu cofator, nicotinamida e adenina (NAD), para catalisar a reação de conversão do lactato piruvato.
Catalase
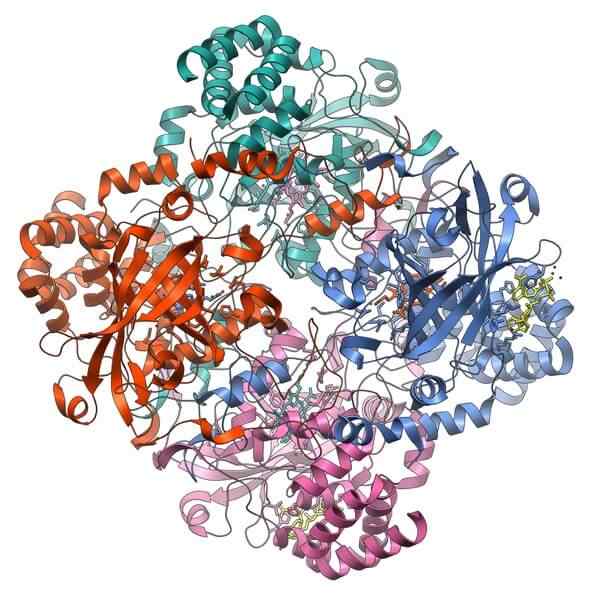 Estrutura da proteína catalase. Fonte: Vossman, CC BY-SA 3.0, via Wikimedia Commons
Estrutura da proteína catalase. Fonte: Vossman, CC BY-SA 3.0, via Wikimedia Commons Catalase é uma holoenzima importante na prevenção da toxicidade celular. Sua função é decompor peróxido de hidrogênio, produto do metabolismo celular, oxigênio e água.
O apoio da catalase exige que dois cofatores sejam ativados: um íon manganês e um grupo protético Hemo, semelhante à hemoglobina.
Referências
- Athappilly, f. K., & Hendrickson, W. PARA. (novecentos e noventa e cinco). Estrutura do domínio biotinil da acetil-coenzima A carboxilase determinada por fases loucas. Estrutura, 3(12), 1407-1419.
- Berg, j., Tymoczko, J., Gatto, g. & Strayer, L. (2015). Bioquímica (8ª ed.). C. H. Freeman and Company.
- FEGLER, J. (1944). Função da anidrase carbônica no sangue. Natureza, 137-38.
- Gaweska, h., & Fitzpatrick, p. F. (2011). Estruturas e mecanismo da família monoamina oxidase. Conceitos biomoleculares, 2(5), 365-377.
- Gupta, v., & Bamezai, r. N. K. (2010). Piruvato humano quinase m2: uma proteína multifuncional. Proteína científica, 19(11), 2031-2044.
- Jitrapakdee, s., St Maurice, M., Rayment, i., Cleland, w. C., Wallace, J. C., & Attwood, P. V. (2008). Estrutura, mecanismo e regulação da piruvato carboxilase. Jornal Bioquímico, 413(3), 369-387.
- Muirhead, h. (1990). Isoenzimas da piruvato quinase. Transações da Sociedade Bioquímica, 18, 193-196.

