Estrutura e funções flagelina
- 2425
- 141
- Mr. Reginald Lindgren
O Flagelina É uma proteína do filamento, que é uma estrutura que faz parte do flagelo de bactérias. A grande maioria das bactérias tem apenas um tipo de flagelo. No entanto, alguns têm mais de dois.
O tamanho molecular desta proteína varia entre 30 kDa e 60 kDa. Por exemplo, em enterobactérias, seu tamanho molecular é grande, enquanto em certas bactérias Sweetacuícolas é pequeno.
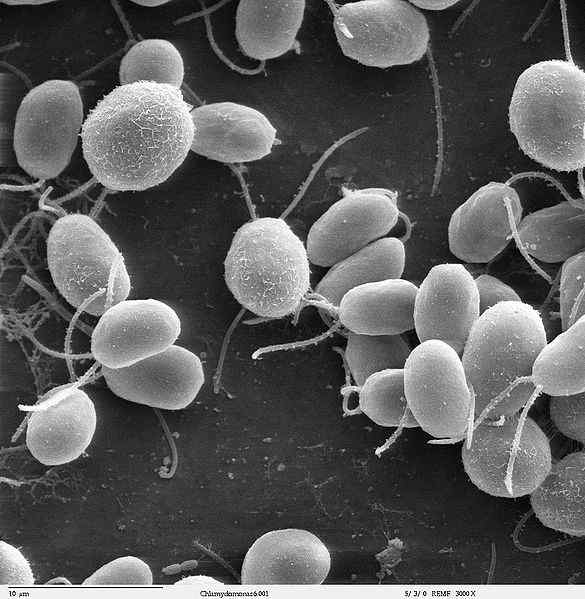
 Fonte: Instalação de Microscópio Eletrônico de Dartmouth, Dartmouth College [DOMAIN PÚBLICO]
Fonte: Instalação de Microscópio Eletrônico de Dartmouth, Dartmouth College [DOMAIN PÚBLICO] Flagelina é um fator de virulência que permite adesão e invasão às células hospedeiras. Além disso, é um ativador poderoso de muitos tipos de células envolvidas na resposta imune inata e adaptativa.
[TOC]
Flagelo e ultraestrutura de mobilidade
O flagelo está ancorado na superfície celular. Consiste em três partes: 1) o filamento, que se estende da superfície da célula e é uma estrutura cilíndrica oca e rígida; 2) o corpo basal, que é incorporado nas paredes da parede e da membrana celular, formando vários anéis; e 3) o gancho, uma estrutura curta curva que se junta ao corpo basal ao filamento.
O corpo basal é a parte mais complexa do flagelo. Em bactérias gram -negativas, possui quatro anéis conectados a uma coluna central. Nos gramas positivos, tem dois anéis. O movimento rotacional do flagelo ocorre no corpo basal.
A localização dos flagelos na superfície das bactérias varia amplamente entre os organismos, sendo capaz de ser: 1) Monric, com apenas um flagelo; 2) polar, com dois ou mais; ou 3) peritrico, com muitos flagelos laterais. Há também endoflagelos, como nos espiroquetas, que estão localizados no espaço perplapsmico.
Helicobacter pylori É muito móvel porque tem seis a oito flagelos unipolares. Um gradiente de pH através do muco permite H. pylori Oriente e estabeleça em uma área adjacente às células epiteliais. Pseudomonas Possui um flagelo polar, que exibe quimiotaxia para açúcares e está associado à virulência.
Estrutura flaginética
Uma característica da sequência de proteínas de tagarelas é que suas regiões N-terminal e C-terminal são altamente preservadas, enquanto a região central é altamente variável entre espécies e subespécies do mesmo gênero. Essa hipervariabilidade é responsável por centenas de sorotipos de Salmonella spp.
Pode atendê -lo: Serratia MarcescensAs moléculas de flagelina interagem entre as regiões terminais e polimerizam a formação de um filamento. Nisso, as regiões terminais estão no interior da estrutura cilíndrica do filamento, enquanto o centro é exposto.
Ao contrário dos filamentos de tubulina que são despolimerizados na ausência de sais, as bactérias são muito estáveis na água. Aproximadamente 20.000 subunidades de tubulina formam um filamento.
No filamento de H. pylori e Pseudomonas aeruginosa Dois tipos de flagelo e flacimento são polimerizados, codificados pelo gene flic. Flaa são heterogêneos e são subdivididos em vários subgrupos, com massas moleculares que variam entre 45 e 52 kDa. Flab é homogêneo com uma massa molecular de 53 kDa.
Freqüentemente, os resíduos de lisina da flagelina são metilados. Além disso, existem outras modificações, como glisilação de Flaa e fosforilação do desperdício de tirosina, cujas funções são, respectivamente, virulência e sinal de exportação.
Crescimento do filamento de flagery em bactérias
O flagelo de bactérias pode ser experimentado experimentalmente, sendo possível estudar sua regeneração. As subunidades flagelina são transportadas pela região interna desta estrutura. Quando chegam ao fim, as subunidades estão adicionando espontaneamente com a ajuda de uma proteína ("Cap Protein") chamada HAP2 ou Floid.
A síntese do filamento ocorre através de sua própria assembléia; isto é, a polimerização do flagelo não requer enzimas ou fatores.
As informações para a montagem do filamento são encontradas na própria subunidade. Assim, a flagelina subunidades polimerize a formação de onze protofilamentos, que formam um completo.
Síntese flagelina de P. Aeruginosa e Proteus mirabilis É inibido por antibióticos como eritromicina, claritromicina e azitromicina.
Flagelina como ativador do sistema imunológico
Os primeiros estudos mostraram que o flagelo, em concentrações subnomolares, de Salmonella, É um poderoso indutor de citocinas em uma linha celular promocital.
Pode atendê -lo: zoósporosPosteriormente, foi demonstrado que a indução da resposta pró -inflamatória implica uma interação entre o flagelo e os receptores de superfície das células do sistema imunológico inato.
Os receptores de superfície que interagem com a flagelina são os do tipo Toll-5 (TLR5). Posteriormente, estudos com flagelo recombinante mostraram que, quando faltava a região hipervariável, não conseguiu induzir uma resposta imune.
O TLR5 está presente em células do sistema imunológico, como linfócitos, neutrófilos, monócitos, macrófagos, células dendríticas, células epiteliais e nódulos linfáticos. No intestino, o TLR5 regula a composição da microbiota.
Bactérias gram-negativas geralmente usam o sistema secretor Tipo III para translocalizar o flagelo para o citoplasma da célula hospedeira, que desencadeia uma série de eventos intracelulares. Assim, o flageline no ambiente intracelular é reconhecido pelas proteínas da família NAIP (um inibidor da apoptose/família NLR).
Posteriormente, o complexo Flagelina-NAIP5/6 interage com o receptor do tipo NOD, que gera a resposta do host à infecção e danos.
Flagelina e plantas
As plantas reconhecem esta proteína por meio de detecção 2 do flagelo (FLS2). Este último é um receptor de quinase em repetições de leucina e é uma contraparte do TLR5. FLS ”interage com a região N-terminal de La Flagelina.
A união da flagelina para FLS2 produz fosforilação da estrada MAP quinase, que culmina com a síntese de proteínas que mediam a proteção contra infecções fúngicas e bactérias.
Em algumas plantas de Solanáceas, o flagelo também pode se juntar ao receptor FLS3. Dessa maneira, estes são protegidos contra patógenos que evitam a defesa mediada por FLS2.
Flagelina como adjuvante
Um adjuvante é um material que aumenta a célula ou a resposta humoral a um antígeno. Como muitas vacinas produzem uma resposta imune baixa, é necessário ter bons adjuvantes.
Pode servir a você: bactérias heterotróficas: características e exemplos de espéciesNumerosos estudos demonstraram a eficácia do flagelo como um adjuvante. Essas investigações consistiram no uso da flagelina recombinante em vacinas, avaliadas por modelos animais. No entanto, esta proteína ainda é superada pela Fase I de ensaios clínicos.
Entre as flagelinas recombinantes estudadas estão: Flagelina-epítopo 1 da hematoglutinina do vírus influenza; Flagelina-epítopo Schistosoma Mansoni; Calor estável para aquecer E. coli; Flagelina -Proteína 1 da superfície de Plasmodium; e flagelina-proteína do envoltório do vírus do Nilo, entre outros recombinantes.
Existem algumas vantagens no uso da flagelina como adjuvante em vacinas de uso humano. Essas vantagens são as seguintes:
1) É eficaz em doses muito baixas.
2) Eles não estimulam a resposta de IgE.
3) Você pode inserir a sequência de outro adjuvante, AG, na sequência de flagelo sem afetar o sinal do flageline via TLR5.
Outros usos da flagelin
Como os genes da flagelina exibem ampla variação, podem ser usados para realizar detecções específicas ou alcançar a identificação de espécies ou cepas.
Por exemplo, a combinação de PCR/RFLP foi usada para estudar a distribuição e o polimorfismo dos genes flagelinos em isolados E. coli da América do Norte.
Referências
- Hajam, i. PARA., Dar, p. PARA., Shahnawaz, i., Jaume, J. C., Leia, j. H. 2017. Flallin bacteriano - um agente imunomodulador de energia. Medicina Experimental e Molecular, 49, E373.
- Kawamura-Sato, k., Inuma, e., Hasegawa, t., Horii, t., Yamashino, t., Ohta, m. 2000. Efeito das concentrações de subinibitorismo de macrólidos na expressão de flamelina em Pseudomonas aeruginosa e Proteus mirabilis. Agentes antimicrobianos e quimioterapia, 44: 2869-2872.
- Mizel, s. B., Bates, j. T. 2010. Flallin como um atjuvante: mecanismos celulares e potencial. Journal of Immunology, 185, 5677-5682.
- Prescott, l. M., Harley, J. P., Klain, s. D. 2002. Microbiologia. MC Graw-Hill, Nova York.
- Schaechter, m. 2009. A mesa eniclopédia da microbiologia. Academic Press, San Diego.
- Winstanley, c., Morgan, a. C. 1997. O gene da flamelina bacteriana como biomarcador para detecção, genética populacional e análise epidemiológica. Microbiology, 143, 3071-3084.
- « Características e classificação do parazoa
- Características da parede celular bacteriana, biossíntese, funções »

