Estrutura primária dos recursos
- 4817
- 996
- Conrad Schmidt
O estrutura primária de proteínas É a ordem em que os aminoácidos dos polipeptídeos que compõem são organizados. Uma proteína é um biopolímero formado por monômeros α-aminoácidos unidos por ligações peptídicas. Cada proteína tem uma sequência definida desses aminoácidos.
As proteínas executam uma enorme diversidade de funções biológicas, incluindo moldar e manter a integridade das células através do citoesqueleto, defender o corpo de agentes estranhos através de anticorpos e catalisar as reações químicas do organismo através de enzimas.
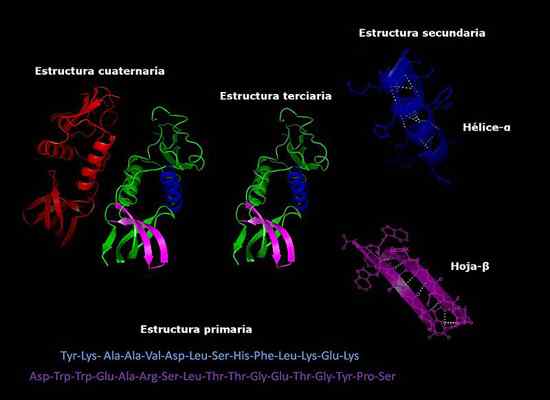
 Estruturas primárias, secundárias, terciárias e quaternárias de proteínas, conformação tridimensional. Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Estruturas primárias, secundárias, terciárias e quaternárias de proteínas, conformação tridimensional. Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Atualmente, a determinação da composição das proteínas e a ordem em que os aminoácidos (sequenciamento) estão dispostos é mais rápido do que anos atrás. Esta informação é depositada em bancos de dados eletrônicos internacionais, que podem ser acessados pela Internet (Genbank, PIR, entre outros).
[TOC]
Aminoácidos
Aminoácidos são moléculas que contêm um grupo amino e um grupo de ácido carboxílico. No caso dos α-aminoácidos, eles têm um átomo de carbono central (carbono α) ao qual estão unidos, tanto o grupo amino quanto o grupo carboxila, além de um átomo de hidrogênio e um grupo R distinto, que é chamado de lado corrente.
Devido a essa configuração de carbono α, os aminoácidos formados, conhecidos como α-aminoácidos, são quirais. Existem duas formas que são imagens espelhadas uma da outra e são chamadas de enantiômeros L e D.
Todas as proteínas dos seres vivos são formados por 20 α-aminoácidos Configuração l. As cadeias laterais desses 20 aminoácidos são diferentes e têm uma grande diversidade de grupos químicos.
Basicamente, os α-aminoácidos podem ser agrupados (arbitrariamente), dependendo do tipo de cadeia lateral da seguinte maneira.
Aminoácidos alifáticos
Neste grupo, eles estão contidos, segundo alguns autores, glicina (GLI), alanina (asa), valina (Val), Leucina (Leu) e isoleucina (ILE). Outros autores também incluem metionina (MET) e prolina (Pro).
Pode atendê -lo: fosfolipídios: características, estrutura, funções, tiposAminoácidos com cadeias laterais contendo hidroxila ou enxofre
Ele contém a serina (Ser), Cisteína (Cys), Treonina (THR) e também metionina. Segundo alguns autores, o grupo deve incluir apenas ser e thr.
Aminoácidos cíclicos
Integrado apenas pela prolina, que, como já apontado, é incluído por outros autores entre aminoácidos alifáticos.
Aminoácidos aromáticos
Fenilalanina (PHE), tirosina (Tyr) e Triphafano (TRP).
Aminoácidos básicos
Histidina (His), Lysine (Lys) e Arginina (Arg)
Aminoácidos ácidos e suas amidas
Ele contém ácidos aspárticos (ASP) e glutâmico (Glu) e também aspargina (ASN) e glutamina (GLN). Alguns autores separam o último grupo em dois; Por um lado, o de aminoácidos ácidos (os dois primeiros) e, por outro, aqueles que contêm carboxilamida (os dois restantes).
Links peptídicos
Os aminoácidos podem se unir através de links peptídicos. Esses links, também chamados de links amida, são estabelecidos entre o grupo α-amino de um aminoácido e o grupo α-carboxil de outro. Esta união é formada com a perda de uma molécula de água.
A união entre dois aminoácidos resulta na formação de um dipéptide, e se novos aminoácidos forem adicionados, sequencialmente, tripid, tetrapéptides e assim por diante.
Os polipeptídeos formados por um pequeno número de aminoácidos, recebem o nome geral dos oligopeptídeos e se o número de aminoácidos for alto, os polipeptídeos serão chamados.
Cada aminoácido que é adicionado à cadeia polipeptídica libera uma molécula de água. A parte do aminoácido que perdeu o h+ ou oh- durante a união é chamada de resto do aminoácido.
A maioria dessas cadeias de oligopeptídeos e polipeptídeos apresentará, em uma extremidade, um grupo amino-terminal (N-terminal) e, no outro, um terminal carboxil (C-terminal). Além disso, eles podem conter muitos grupos ionizáveis entre as cadeias laterais do resíduo de aminoácidos que os compreende. Por causa disso, polianfolites são consideradas.
Pode atendê -lo: Flora e Fauna de Campeche: Espécies Representativas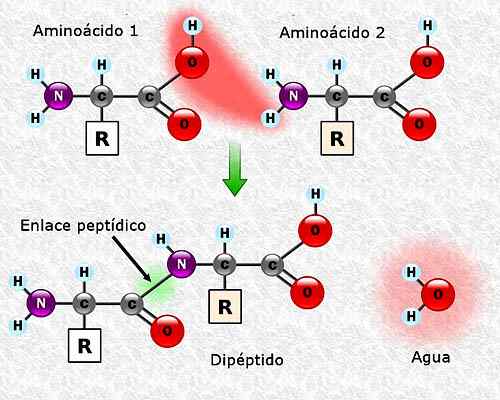 Formação de uma ligação peptídica entre dois aminoácidos. Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)].
Formação de uma ligação peptídica entre dois aminoácidos. Tomado e editado de: Alejandro Porto [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)]. Sequência de aminoácidos
Cada proteína tem uma certa sequência de seus resíduos de aminoácidos. Esta ordem é o que é conhecido como a estrutura principal da proteína.
Cada proteína individual de cada organismo é específica para a espécie. Ou seja, a mioglobina de um ser humano é idêntica à de outro ser humano, mas tem pequenas diferenças com os mioglobinos de outros mamíferos.
A quantidade e os tipos de aminoácidos que uma proteína contém é tão importante quanto a localização desses aminoácidos dentro da cadeia polipeptídica. Para conhecer as proteínas, os bioquímicos devem primeiro isolar e purificar cada proteína específica, depois fazer uma análise do teor de aminoácidos e finalmente determinar sua sequência.
Para isolar e purificar proteínas, existem métodos diferentes, entre os quais: centrifugação, cromatografia, filtração em gel, diálise e ultrafiltração, bem como o uso de propriedades de solubilidade de proteínas em estudo em estudo.
A determinação dos aminoácidos presentes nas proteínas é realizada após três etapas. O primeiro é quebrar as ligações peptídicas por hidrólise. Posteriormente, os diferentes tipos de aminoácidos da mistura são separados; E finalmente, cada um dos tipos de aminoácidos obtidos é quantificado.
Para determinar a estrutura primária da proteína, diferentes métodos podem ser usados; Mas atualmente o mais utilizado é o método de Edman, que basicamente consiste na marcação e separação do aminoácido N-terminal do restante da cadeia repetidamente, e identificando cada aminoácido liberado individualmente.
Codificação de proteínas
A estrutura primária das proteínas é codificada nos genes do organismo. A informação genética está contida no DNA, mas para a tradução de proteínas deve primeiro ser transcrita para moléculas RNM. Cada trigêmeo de nucleotídeo (códon) codifica um aminoácido.
Pode atendê -lo: qual é a composição química dos seres vivos?Como existem 64 códons possíveis e apenas 20 aminoácidos são usados na construção de proteínas, cada aminoácido pode ser codificado por mais de um códon. Praticamente todos os seres vivos usam os mesmos códons para codificar os mesmos aminoácidos. Portanto, o código genético é considerado uma linguagem quase universal.
Neste código, existem códons usados para iniciar e também impedir a tradução do polipeptídeo. Os códons de conclusão não codificam nenhum aminoácido, mas param a tradução para o terminal C da cadeia e são representados pelos trigêmeos UAA, UAG e UGA.
Por outro lado, o códon Aug normalmente funciona como um sinal de partida e também codifica a meção.
Após a tradução, as proteínas podem sofrer algum processamento ou modificação, como a minhoca curta, para alcançar sua configuração definitiva.
Referências
- C.K. Mathews, k.E. Van hold & k.G. Ahern. 2002. Bioquímica. 3º Edição. Benjamin / Cummings Publishing Company, Inc.
- Murray, p. Mayes, d.C. Granner & V.C. Rodwell. mil novecentos e noventa e seis. Bioquímica de Harper. Appleton & Lange
- J.M. Berg, j.eu. Tymoczko & l. Stryer (SF). Bioquímica. 5º Edição. C. H. Freeman and Company.
- J. Koolman & k.-H. Roehm (2005). Atlas de cor bioquímica. 2Nd Edição. Thieme.
- PARA. Lehninger (1978). Bioquímica. Omega Editions, S.PARA.
- eu. Stryer (1995). Bioquímica. C.H. Freeman and Company, Nova York.
- « Histórico de números Avogadro, unidades, como é calculado, usa
- Características, estrutura e funções da exonuclease »

