Equações de equilíbrio térmico, aplicações, exercícios

- 4457
- 371
- Mr. Reginald Lindgren
O equilíbrio térmico de dois corpos que estão em contato térmico é o estado que é alcançado após um tempo suficiente para que as temperaturas de ambos os corpos sejam iguais a.
Na termodinâmica, o contato térmico de dois corpos (ou dois sistemas termodinâmicos) é entendido como uma situação em que os corpos têm contato mecânico ou são separados, mas em contato com uma superfície que permite apenas a passagem de calor de um corpo para o outro (superfície diatérmica ).
-
 figura 1. Depois de um tempo, o gelo e a bebida atingirão seu equilíbrio térmico. Fonte: Pixabay
figura 1. Depois de um tempo, o gelo e a bebida atingirão seu equilíbrio térmico. Fonte: Pixabay
Em contato térmico, não deve haver reação química entre os sistemas em contato. Somente deve haver troca de calor.
Situações diárias em que há troca de calor são apresentados com sistemas como bebida gelada e vidro, café quente e colher de chá ou corpo e termômetro, entre muitos outros exemplos.
[TOC]
Quando dois ou mais sistemas estão em equilíbrio térmico?
A segunda lei da termodinâmica estabelece que o calor sempre passa do corpo de temperatura mais alto para a temperatura mais baixa. A transferência de calor cessa assim que as temperaturas são equalizadas e o status de equilíbrio térmico é atingido.
A aplicação prática do equilíbrio térmico é o termômetro. Um termômetro é um dispositivo que mede sua própria temperatura, mas graças ao equilíbrio térmico, podemos conhecer a temperatura de outros corpos, como a de uma pessoa ou animal.
O termômetro da coluna de mercúrio é colocado em contato térmico com o corpo, por exemplo, sob a língua, e espera -se que o tempo suficiente atinja o equilíbrio térmico entre o corpo e o termômetro e que sua leitura não varia mais.
Quando esse ponto é atingido, a temperatura do termômetro é a mesma que o corpo.
A lei zero da termodinâmica estabelece que, se um corpo A estiver em equilíbrio térmico com um corpo C e o mesmo corpo C está em equilíbrio térmico com B, então A e B estão em equilíbrio térmico, mesmo quando entre A e B não há contato térmico.
Concluímos que dois ou mais sistemas estão em equilíbrio térmico quando têm a mesma temperatura.
Equações de equilíbrio térmico
Assumimos um corpo à temperatura inicial em contato térmico com outro corpo B com temperatura inicial TB. Também assumimos que Ta> TB, então, de acordo com a segunda lei, o calor é transferido de A para B.
Depois de um tempo, o equilíbrio térmico será alcançado e os dois corpos terão a mesma temperatura final TF. Isso terá um valor intermediário para TA e TB, isto é, ta> tf> tb.
A quantidade de calor transferida de A para B será qa = ma ca (tf - ta), onde ma é a massa do corpo a, ca a capacidade de calor por unidade de massa de um y (tf - ta) a diferença de temperatura. Se TF for menor que o QA é negativo, indicando que o corpo dá calor.
Da mesma forma, para o corpo B, você precisa qb = mb cb (tf - tb); E se o TF for maior que a TB, o QB é positivo, indicando que o corpo B recebe calor. Como o corpo A e B estão em contato térmico entre eles, mas isolados do ambiente, a quantidade total de calor trocada deve ser nula: QA + QB = 0
Então ma ca (tf - ta) + mb cb (tf - tb) = 0
Temperatura do equilíbrio
Desenvolvendo essa expressão e limpeza a temperatura TF, a temperatura final de equilíbrio térmico é obtida.
-
 Figura 2. Temperatura de equilíbrio final. Fonte: Self feito
Figura 2. Temperatura de equilíbrio final. Fonte: Self feito
Tf = (ma ca ta + mb cb tb) / (ma ca + mb cb).
Como um caso específico, considere o caso de que os corpos A e B são idênticos em massa e em capacidade de calor, neste caso a temperatura de equilíbrio será:
Tf = (ta + tb) / 2 ↔ se ma = mb e ca = cb.
Contato térmico com a mudança de fase
Em algumas situações, acontece que quando dois corpos são colocados em contato térmico, a troca de calor causa a mudança de estado ou fase em um deles. Se isso acontecer, deve -se levar em consideração que, durante a mudança de fase, não há mudança de temperatura no corpo que está modificando seu status.
Se a mudança de fase de um dos corpos no contato térmico ocorrer, o conceito de calor latente l é aplicado, que é a energia por unidade de massa necessária para a mudança de estado:
Q = l ∙ m
Por exemplo, para derreter 1 kg de gelo a 0 ° C, 333,5 kJ/kg são necessários e esse valor é o calor latente de fusão de gelo.
Durante a fusão, a água sólida é alterada para água líquida, mas essa água mantém a mesma temperatura de gelo durante o processo de fusão.
Formulários
O equilíbrio térmico faz parte da vida cotidiana. Por exemplo, vamos examinar esta situação em detalhes:
-Exercício 1
Uma pessoa deseja tomar banho com água morna a 25 ° C. Em um cubo, coloque 3 litros de água fria a 15 ° C e na cozinha aquece água até 95 ° C.
Quantos litros de água quente devem adicionar ao cubo de água fria para ter a temperatura final desejada?
Solução
Suponha que seja água fria e água quente:
-
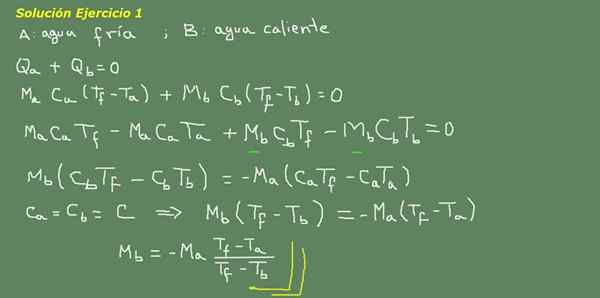 Figura 3. Exercício 3 Solução. Fonte: Self feito.
Figura 3. Exercício 3 Solução. Fonte: Self feito.
Propomos a equação de equilíbrio térmico, conforme indicado no Conselho da Figura 3 e a partir daí limpamos a água MB.
A massa inicial de água fria pode ser obtida porque a densidade da água é conhecida, que é de 1 kg para cada litro. Isto é, temos 3 kg de água fria.
MA = 3kg
Então
Mb = - 3 kg*(25 ° C - 15 ° C)/(25 ° C - 95 ° C) = 0,43 kg
Então é suficiente com 0,43 lts de água quente para finalmente obter 3,43 litros de água morna a 25 ° C.
Exercícios resolvidos
-Exercício 2
Um pedaço de metal de 150 g de massa é introduzido e com temperatura de 95 ° C para um recipiente contendo meio litro de água a uma temperatura de 18 ° C. Depois de um tempo, o equilíbrio térmico e a temperatura da água e do metal são atingidos é 25 ° C.
Suponha que o recipiente com água e peça de metal seja uma garrafa térmica fechada que não permita a troca de calor com o ambiente.
Obter o calor específico do metal.
Solução
Primeiro, calcularemos o calor absorvido pela água:
Qa = ma ca (tf - ta)
QA = 500g 1Cal/(g ° C) (25 ° C - 18 ° C) = 3500 calorias.
Esse é o mesmo calor dado pelo metal:
QM = 150g cm (25 ° C - 95 ° C) = -3500 Calorias.
Então podemos obter a capacidade de calor do metal:
Cm = 3500 cal/ (150g 70 ° C) = ⅓ Cal/ (g ° C).
Exercício 3
Você tem 250 c.c. de água a 30 ° C. Para aquela água que está em uma garrafa térmica isolante, são adicionados 25g de cubos de gelo a 0 ° C, com o objetivo de resfriá -lo.
Determinar a temperatura de equilíbrio; isto é, a temperatura que permanecerá assim que todo o gelo derreter e a água gelada aquecer até a água que inicialmente tinha o vidro.
Solução 3
Este exercício pode ser resolvido em três etapas:
- O primeiro é a fusão de gelo que absorve o calor da água inicial para derreter e se tornar água.
- Então a diminuição da temperatura na água inicial é calculada, porque deu calor (QCED<0) para fundir el hielo.
- Finalmente, a água derretida (do gelo) deve ser termicamente equilibrada com a água que existia inicialmente.
-
 Figura 4. Exercício 3 Solução. Fonte: Self feito.
Figura 4. Exercício 3 Solução. Fonte: Self feito.
Vamos calcular o calor necessário para a fusão de gelo:
Qf = l * mh = 333,5 kJ/kg * 0,025kg = 8.338 kJ
Então, o calor atribuído pela água para derreter o gelo é QCED = -QF
Esse calor atribuído pela água desce sua temperatura a um valor T 'que podemos calcular o seguinte:
T '= T0 - QF/(MA*CA) = 22,02 ° C
Onde CA é a capacidade de calor da água: 4,18 kJ/(kg ° C).
Finalmente, a massa original de água que está agora a 22,02 ° C produzirá calor para a água fundida do gelo que está a 0 ° C.
Finalmente, a temperatura do equilíbrio será alcançada após tempo suficiente:
Te = (ma * t ' + mh * 0 ° C) / (ma + mh) = (0,25kg * 22,02 ° C + 0,025kg * 0 ° C) / (0,25kg + 0,025kg).
Finalmente obtendo a temperatura de equilíbrio:
TE = 20,02 ° C.
-Exercício 4
Uma peça de chumbo de 0,5 kg deixa o forno a uma temperatura de 150 ° C, o que está bem abaixo do seu ponto de fusão. Essa peça é colocada em um recipiente com 3 litros de água à temperatura ambiente de 20 ° C. Determine a temperatura final de equilíbrio.
Também calcule:
- Quantidade de calor entregue pelo chumbo à água.
- Quantidade de calor absorvido pela água.
Dados:
Calor específico de chumbo: cp = 0,03 cal/(g ° C); Calor de água específico: Ca = 1 limão/(g ° C).
Solução
Em primeiro lugar, determinamos a temperatura de equilíbrio final te:
TE = (ma Ca ta + MP CP TP) / (ma ca + mp cp)
TE = 20,65 ° C
Então a quantidade de calor atribuída pelo chumbo é:
QP = MP CP (TE - TP) = -1,94 x 10³ Lima.
A quantidade de calor absorvida pela água será:
Qa = ma ca (te - ta) = +1,94x 10³ limão.
Referências
- Atkins, p. 1999. Química Física. Edições Omega.
- Bauer, w. 2011. Física para engenharia e ciências. Volume 1. Mc Graw Hill.
- Giancoli, d. 2006. Física: Princípios com aplicações. 6º ... Ed Prentice Hall.
- Hewitt, Paul. 2012. Ciência física conceitual. 5 ª. Ed. Pearson.
- Resnick, r. (1999). Físico. Vol. 1. 3ª ed. em espanhol. Empresa Editorial Continental S.PARA. claro.V.
- Rex, a. 2011. Fundamentos da Física. Pearson.
- Sears, Zemansky. 2016. Física da Universidade com Física Moderna. 14º. Ed. Volume 1.
- Serway, r., Jewett, J. (2008). Física para Ciência e Engenharia. Volume 1. 7º. Ed. Cengage Learning.
- « Características contínuas do sistema de produção, vantagens, exemplos
- A revolução liberal do Equador causa, desenvolvimento e consequências »

