Tipos de ciclooxigenase, reação, inibidores
- 1362
- 109
- Pete Wuckert
As ciclooxigenases (COXS), também conhecido como prostaglandina H sintase ou prostaglandina endoperóxido Synthesasas, são enzimas de ácidos graxos oxigenase que pertencem à superfamília da mieloperoxidase e encontrados em todos os animais vertebrados.
As cycoxigenases são enzimas bifuncionais, pois têm duas atividades catalíticas diferentes: uma atividade de ciclooxigenase e outra peroxidase, que lhes permitem catalisar o Bis-Oxigenação e redução de ácido araquidônico para formar prostaglandina.
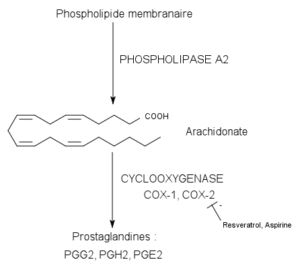 Reação catalizada por enzimas cicloxigenase (fonte: pancrat [cc by-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Reação catalizada por enzimas cicloxigenase (fonte: pancrat [cc by-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Eles não foram encontrados em plantas, insetos ou em organismos unicelulares, mas nas células de vertebrados essas enzimas, vesículas etc.
As primeiras detecções dos produtos sintetizadas pelas ciclooxigenases foram feitas em fluidos seminais, por isso se pensava inicialmente que eram substâncias produzidas na próstata, e é por isso que foram chamadas de "prostaglandinas".
Hoje sabe -se que as prostaglandinas são sintetizadas em todos os tecidos dos animais de vertebrados e mesmo em organismos que não possuem glândulas próstatas, e que os diferentes isômeros dessas moléculas têm várias funções em diferentes processos fisiológicos e patológicos, como febre, sensibilidade ao para o Sensibilidade à dor ou álgeas, inflamação, trombose, misotogênese, vasodilatação e vasoconstrição, ovulação. função renal, etc.
[TOC]
Pessoal
A existência de dois tipos de ciclooxigenases entre animais de vertebrados foi relatada. O primeiro a ser descoberto e purificado é conhecido como Cox-1 ou simplesmente Cox, e foi purificado pela primeira vez em 1976 a partir das vesículas seminais de ovelhas e vacas.
A segunda cicloxigenase descoberta entre os eucariotos foi a COX-2, em 1991. Até o momento, ficou provado que todos os animais de vertebrados, incluindo peixes cartilaginosos, peixes ósseos, pássaros e mamíferos, têm dois genes que codificam para enzimas de Cox.
Pode atendê -lo: circulação de fungos: nutrientes, substâncias, osmorregulaçãoUm deles, COX-1, codifica para a ciclooxigenase 1, que é constitutiva, enquanto o gene COX-2 codifica para a ciclooxigenase induzível.
Características de ambos os genes e seus produtos enzimáticos
As enzimas COX-1 e COX-2 são bastante semelhantes, o que é entendido como 60-65% de similaridade entre suas sequências de aminoácidos.
Os genes COX-1 Ortólogos (genes em diferentes espécies que têm a mesma origem) em todas as espécies de animais de vertebrados produzem proteínas COX-1 que compartilham até 95% da identidade de suas sequências de aminoácidos, o que também é verdadeiro para os ortólogos de COX-2, cujos produtos compartilham entre 70 e 90% de identidade.
Cnidários e ascídias também têm dois genes Cox, Mas estes são diferentes dos de outros animais, então alguns autores levantam a hipótese de que esses genes poderiam ter surgido em eventos de duplicação independentes do mesmo ancestral comum.
COX-1
O gen Cox-1 pesa aproximadamente 22 kb e é constitutivamente expresso para codificar a proteína COX-1, que possui cerca de 600 resíduos de aminoácidos antes de ser processada, pois possui um peptídeo de sinal hidrofóbico após cuja remoção paga uma proteína de aproximadamente 576 aminoácidos.
Esta proteína está principalmente no retículo endoplasmático e sua estrutura geral está na forma de um homodímero, ou seja, duas cadeias polipeptídicas idênticas que estão associadas para formar a proteína ativa.
COX-2
O gen Cox-2, por outro lado, pesa cerca de 8 kb e sua expressão é induzida por citocinas, fatores de crescimento e outras substâncias. Isso codifica a enzima COX-2 que possui, incluindo o peptídeo de sinal, 604 resíduos de aminoácidos e 581 após o processamento.
Pode atendê -lo: respiração anaeróbicaEsta enzima também é homodimérica e é entre o retículo endoplasmático e o nuclear embrulhado.
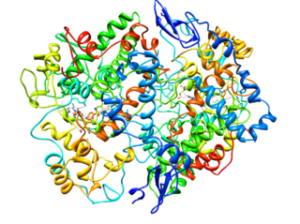 Estrutura molecular da cicloxigenase tipo 2 (COX-2) (fonte: citocromo c na Wikipedia inglesa [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Estrutura molecular da cicloxigenase tipo 2 (COX-2) (fonte: citocromo c na Wikipedia inglesa [CC BY-SA 3.0 (https: // CreativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) A partir da análise de suas estruturas, foi determinado que a COX-1 e a enzima cox-2 inglês Fator de crescimento epidérmico).
Neste módulo, são extremamente preservadas ligações de dissulfeto ou pontes, que funcionam como "domínio de dimerização" entre os dois polipeptídeos de cada enzima homodimérica.
As proteínas também têm hélices anfipáticas que facilitam a ancoragem a uma das camadas de membrana. Além disso, o domínio catalítico de ambos possui dois locais ativos, um com atividade de ciclooxigenase e outro com atividade de peroxidase.
Ambas as enzimas são proteínas extremamente preservadas, estando entre diferentes espécies pequenas diferenças significativas em relação aos mecanismos de dimerização e união para a membrana, bem como algumas características de seus domínios catalíticos.
As proteínas Cox também têm locais de glicosilação que são essenciais para sua operação e que são absolutamente preservados.
Reação
As enzimas 1 e 2 da cicloxigenase são responsáveis por catalisar as duas primeiras etapas da biossíntese da prostaglandina, que começam com a conversão do ácido araquidônico em precursores de prostaglandinas conhecidas como hidroperóxi-endoperóxido PGG2.
Para que essas enzimas exerçam suas funções, elas devem primeiro ser ativadas por meio de um processo dependente de sua atividade de peroxidase. Em outras palavras, sua principal atividade depende da redução de um substrato de peróxido (mediado pelo local ativo da peroxidase) para que a oxidação do ferro associada ao grupo Hemo que serve como cofator ocorra.
Pode servir a você: Monera Kingdom: Características, Classificação e ExemplosA oxidação do grupo Hemo causa a formação de um radical tirosil no local ativo ciclooxigenase, que ativa a enzima e promove o início da reação da ciclooxigenase. Essa reação de ativação pode ocorrer apenas uma vez, pois o radical tirosil é regenerado durante a última reação da rota.
Inibidores
As ciclooxigenases estão envolvidas na síntese de prostaglandinas, que são hormônios com funções na proteção da mucosa intestinal, na agregação de plaquetas e na regulação da função renal, além de participar dos processos de inflamação, dor e dor e febre.
Em vista do fato de que essas enzimas são essenciais para a produção desses hormônios, especialmente aqueles que têm a ver com processos inflamatórios, numerosos estudos farmacológicos se concentraram na inibição das ciclooxigenaseses.
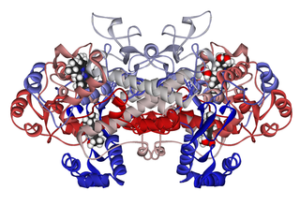 Estrutura molecular da cicloxigenase 1 ligada ao ibuprofeno (Fonte: FVasconcellos 5 de maio de 2007 [domínio público] via Wikimedia Commons)
Estrutura molecular da cicloxigenase 1 ligada ao ibuprofeno (Fonte: FVasconcellos 5 de maio de 2007 [domínio público] via Wikimedia Commons) Assim, foi demonstrado que o mecanismo de ação de muitos medicamentos anti-inflamatórios não esteróides tem a ver com acetilação irreversível ou reversível (inibitória) do local ativo ciclooxigenase nessas enzimas.
Entre essas drogas estão piroxicam, ibuprofeno, aspirina, flurbiprofeno, diclofenac, naproxeno e outros.
Referências
- Botting, r. M. (2006). Inibidores de ciclooxigenases: mecanismos, seletividade e usos. Jornal de Fisiologia e Farmacologia, 57, 113.
- Chandrasekharan, n. V., & Simmons, D. eu. (2004). As ciclooxigenases. Genome Biology, 5 (9), 241.
- Fitzpatrick, f. PARA. (2004). Enzimas de ciclooxigenase: regulação e função. Current Pharmaceutical Design, 10 (6), 577-588.
- Kundu, n., Smyth, m. J., Samsel, l., & Fulton, para. M. (2002). Os inibidores da ciclooxigenase bloqueiam o crescimento celular, aumenta a ceramida e inibem o ciclo celular. Pesquisa e tratamento para câncer de mama, 76 (1), 57-64.
- Rauzer, c. PARA., & Marnett, L. J. (2009). Cyclooxigenases: Insights estruturais e funcionais. Journal of Lipid Research, 50 (suplemento), S29-S34.
- Vane, J. R., Bakhle, e. S., & Botting, r. M. (1998). Ciclooxigensões 1 e 2. Revisão Anual de Farmacologia e Toxicologia, 38 (1), 97-120.

