ALOSTERISMISMISMISMOS Aspectos gerais, funções e exemplos

- 1136
- 176
- Orlando MacGyver
Ele Alosterismo od regulação alóstrica é definida como o processo de inibição ou ativação de uma enzima mediada por uma molécula reguladora diferente de seu substrato e age em um local específico de sua estrutura, diferente do local ativo do mesmo.
O termo "alostérico" ou "alosterismo" vem das raízes gregas "allos ", o que significa "outro" e "Estéios", que significa "forma" ou "lugar"; Então, literalmente, traduz como "outro espaço", "outro lugar" ou "outra estrutura".
 Esquema gráfico de um regulamento teostérico. (A) Site ativo. (B) Site alostérico. (C) substrato. (D) inibidor. (E) enzima. (Fonte: Isaac Webb [CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons)
Esquema gráfico de um regulamento teostérico. (A) Site ativo. (B) Site alostérico. (C) substrato. (D) inibidor. (E) enzima. (Fonte: Isaac Webb [CC BY-S (https: // criativeCommons.Org/licenças/BY-SA/3.0)] via Wikimedia Commons) Alguns autores descrevem o alosterismo como um processo pelo qual locais remotos em um sistema (a estrutura de uma enzima, por exemplo) são acoplados energeticamente para produzir uma resposta funcional, e é por isso que pode ser assumido que uma mudança em uma região pode afetar qualquer outra no mesmo.
Esse tipo de regulação é típico das enzimas que participam de vários processos biológicos conhecidos, como transdução de sinal, metabolismo (anabolismo e catabolismo), a regulação da expressão genética, entre outros.
As primeiras idéias sobre alosterismo e sua participação no controle do metabolismo celular foram postuladas na década de 1960 por f. Monod, f. Jacob e J. Changeux, enquanto estudava as rotas biossintéticas de diferentes aminoácidos, que foram inibidos após o acúmulo dos produtos finais.
Embora a primeira publicação a esse respeito tenha a ver com a regulação genética, pouco tempo depois Monod, Wyman e Changex expandiram a concepção do alosterismo a proteínas com atividade enzimática e propuseram um modelo baseado em proteínas multiméricas, apoiadas principalmente por interações entre subunidades quando qualquer um destes se uniram a um efetor.
Pode atendê -lo: Guanina: características, estrutura, treinamento e funçõesMuitos dos conceitos subsequentes tiveram sua base na teoria do "ajuste induzido" que foi introduzido por Koshland alguns anos antes.
[TOC]
Aspectos gerais
Em geral, todas as enzimas têm dois locais diferentes para a união dos ligantes: um é conhecido como sítio ativo, que se junta às moléculas que funcionam como substrato (responsável pela atividade biológica da enzima), e o outro é conhecido como teosterico site, que é específico para outros metabólitos.
Esses "outros metabólitos" são chamados de efetores alestéricos e podem ter efeitos positivos ou negativos na velocidade das reações catalisadas por enzimas ou na afinidade com a qual se juntam seus substratos no local ativo.
Geralmente, a união de um efetor no AL, um local enzimático causa um efeito em outro local da estrutura, modificando sua atividade ou desempenho funcional.
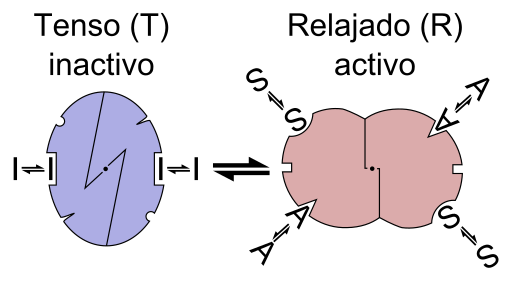 Esquema gráfico da reação de uma enzima alosterica (Fonte: Arquivo: Enzima alostery é.PNG: Arquivo: Enzyme alostery.PNG: Allostery.PNG: Nicolas Le Novere (conversa).Lenov em in.Trabalho de Wikipediaderivative: Timvickers (Talk) Trabalho derivado: Retama (Talk) Trabalho derivado: KES47 [CC BY-SA (https: // CreativeCommonsns.Org/licenças/BY-SA/3.0) via Wikimedia Commons)
Esquema gráfico da reação de uma enzima alosterica (Fonte: Arquivo: Enzima alostery é.PNG: Arquivo: Enzyme alostery.PNG: Allostery.PNG: Nicolas Le Novere (conversa).Lenov em in.Trabalho de Wikipediaderivative: Timvickers (Talk) Trabalho derivado: Retama (Talk) Trabalho derivado: KES47 [CC BY-SA (https: // CreativeCommonsns.Org/licenças/BY-SA/3.0) via Wikimedia Commons) Em outras palavras, a união de um efetor Alestro em seu lugar específico na estrutura de uma enzima causa uma mudança na geometria molecular da enzima, que é conhecida como transição para teostica, ou seja, é um evento que é transmitido em todo o Macromolecule, modificando seu comportamento.
O alosterismo pode ser homotrópico ou heterotrópico. Um processo de regulação aloestróica homotrópica é definida como aquela em que o mesmo substrato de uma enzima atua como seu regulador Alestric, ou seja, que o efetor alostérico é o mesmo substrato; Também é conhecido como um tipo de cooperativa.
Um processo de regulação heterotrópica, por outro lado, refere -se à regulação da atividade de uma enzima mediada por uma molécula ou efetora de theosterica diferente de seu substrato e também pode ter efeitos positivos ou negativos na atividade da enzima.
Pode atendê -lo: Aptenia Cordifolia: características, habitat, propriedades, cultivoFunções
O alosterismo, juntamente com a regulação da expressão genética, tradução e degradação de proteínas, é um dos mecanismos fundamentais para a regulação de um grande número de processos orgânicos, essencial para a manutenção da homeostase e para a sobrevivência todos os vivos, unicelulares ou multicelulares seres.
A regulação ou alosterismo do toostal oferece aos organismos vivos a capacidade de responder com grande sensibilidade às mudanças na concentração de ligantes regulatórios, bem como na de fenômenos rítmicos originários em nível celular.
Como os substratos de energia e metabólica são finitos em uma célula, o alosterismo permite, no campo metabólico, o uso moderado de recursos, evitando os ciclos inúteis e o desperdício de energia para o processamento excessivo de substratos em condições de abundância ou escassez.
Da mesma forma, esse mecanismo de regulação é de grande importância para os processos de sinalização celular, nos quais muitas mudanças conformacionais que são desencadeadas pela união de diferentes ligantes em locais específicos dos receptores em questão estão envolvidos.
Exemplos de alosterismo
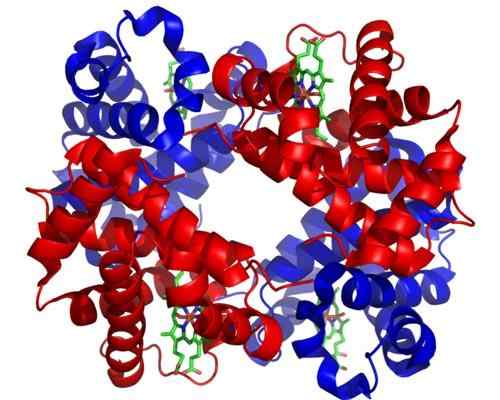 Hemoglobina. Tomado e editado de: Zephyris na Wikipedia da língua inglesa [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]].
Hemoglobina. Tomado e editado de: Zephyris na Wikipedia da língua inglesa [CC BY-SA 3.0 (http: // criativecommons.Org/licenças/BY-SA/3.0/]]. Embora existam milhares de exemplos de Al, para a regulamentação teostica na natureza, alguns foram mais proeminentes do que outros. É o caso da hemoglobina, que foi uma das primeiras proteínas descritas em profundidade no aspecto estrutural.
A hemoglobina é uma proteína muito importante para muitos animais, pois é responsável pelo transporte de oxigênio através do sangue dos pulmões para os tecidos. Esta proteína apresenta regulamentação homotrópica e heterotrópica para teostica ao mesmo tempo.
Pode atendê -lo: salacionismo: características, evidências e exemplosO alosterismo homotrópico da hemoglobina tem a ver com a união de uma molécula de oxigênio a uma das subunidades que a compõem afeta diretamente a afinidade com a qual a subunidade adjacente a outra molécula de oxigênio está ligada, aumentando -a (regulação positiva ou cooperativismo).
Heterotrópico ao heterotrópico
O alosterismo heterotrópico, por outro.
Transcarbamilase ou atcasa aspartato, que participa da rota de síntese de pirimidina, também é um dos exemplos "clássicos" de regulação alostérica. Essa enzima, que possui 12 subunidades, das quais 6 são cataliticamente ativas e 6 são reguladores, é inibida heterotropicamente pelo produto final da rota que chega, o citidininatifosfato (CTP).
Lactose operon E. coli
O fruto das primeiras idéias de Monod, Jacob e Changeaux foi um artigo publicado por Jacob e Monod relacionado à lactose da lactose da lactose de Escherichia coliYo, que é um dos exemplos típicos de regulação heterotrópica a genética.
A regulação do toostal deste sistema não está relacionada à capacidade de converter um substrato em um produto, mas à afinidade da união de uma proteína na região de DNA operacional.
Referências
- Changeux, J. P., & Edelstein, S. J. (2005). Mecanismos alostéricos de transdução de sinal. Science, 308 (5727), 1424-1428.
- Goldbeter, a., & Dupont, g. (1990). Regulação alostérica, cooperidade e oscilações bioquímicas. Biophysical Chemistry, 37 (1-3), 341-353.
- Jiao, w., & Parker, e. J. (2012). Usando uma compinação de técnicas computacionais e experimentais para entender a base molecular da alosteria de proteínas. Em Avanços na Química de Proteínas e Biologia Estrutural (VOL. 87, pp. 391-413). Academic Press.
- Kern, d., & Zuiderweg, e. R. (2003). O papel da dinâmica na regulamentação alostérica. Opinião atual em Biologia Estrutural, 13 (6), 748-757.
- Laskowski, r. PARA., Gerick, f., & Thornton, J. M. (2009). A base estrutural da regulação alostérica em proteínas. FEBS LETTERS, 583 (11), 1692-1698.
- Mathews, c. K., Van holde, k. E., & Ahern, k. G. (2000). Bioquímica, ed. San Francisco, Califórnia.
- « Nanotubos de carbono Estrutura, propriedades, aplicações, toxicidade
- Processo de radiação adaptável, tipos e exemplos »

